فرط كوليسترول الدم العائلي: ما هو وكيفية علاجه
فرط كوليسترول الدم العائلي ، وهو مرض وراثي نادر يسبب عواقب صحية خطيرة (مثل النوبة القلبية والسكتة الدماغية) التي تتطلب تدابير احتواء مناسبة مع الأدوية المناسبة ونمط الحياة المناسب.
ماذا يعني ارتفاع الكولسترول في الدم؟ وماذا تعني الأسرة؟
فرط كوليسترول الدم هو حالة سريرية تتميز بزيادة نسبة الكوليسترول في الدم.
الكوليسترول هو أحد مكونات الدهون ، وعادة ما يتم تناوله مع النظام الغذائي ولكن يمكن أيضًا أن ينتجه الجسم.
يعتبر الكوليسترول مهمًا جدًا للحياة لأنه يستخدم في تكوين أغشية الخلايا (لضمان وظيفتها) ، كما يحمي الخلايا العصبية والأعصاب القحفية.
يستخدم الكوليسترول أيضًا في تخليق جزيئات أخرى ، ثلاثة منها عبارة عن أحماض صفراوية (مهمة للهضم) وبعض الهرمونات وفيتامين د.
فقط في حالة وجوده فوق هذه المتطلبات يمكن أن يتسبب في أضرار جسيمة.
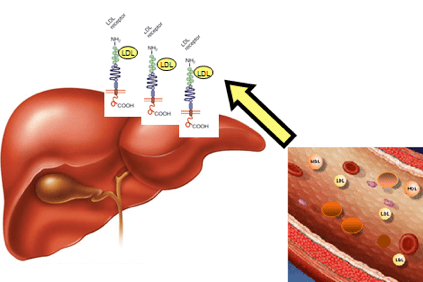
في حالة فرط كوليسترول الدم ، يتراكم الكوليسترول في الدم على شكل بروتينات دهنية خفيفة (LDL) ، وتجمعات معينة من الدهون والبروتينات ، وتسمى أيضًا "الكوليسترول الضار" التي تعزز تكوين لويحات في جدار الشريان (لويحات تصلب الشرايين).
يحدث هذا عندما يكون لدى المرضى مستويات عالية من الكوليسترول لدرجة أنهم لا يستطيعون القضاء عليها من خلال الآليات الفسيولوجية للكبد.
يؤدي تراكم البروتين الدهني منخفض الكثافة في الدم في النهاية إلى تكوين العصيدة (انسداد جسدي لتدفق الدم الطبيعي) مما قد يؤدي إلى عواقب أكثر خطورة مثل الذبحة الصدرية والنوبات القلبية والسكتة الدماغية ، ولكن أيضًا في أعضاء أخرى مثل الدماغ ، الكلى والرئتين والكبد نفسه.
فرط كوليسترول الدم مألوف عند انتقاله إلى النسل
ويرجع ذلك إلى تعديلات في الجين الذي يحتوي على المعلومات لصنع بروتين في الكبد ، وهو مستقبل LDLR (LDLR) ، الذي يتعرف على LDL ، ويزيله من مجرى الدم ، وينقله إلى خلايا الكبد ، ثم تزيله. يتسبب هذا التغيير الجيني في تراكم LDL في الدم.
حتى الآن ، هناك أكثر من 600 تغيير معروف في جين LDL يسبب فرط كوليسترول الدم العائلي.
أيضًا ، يمكن للأشخاص الذين يعانون من هذا الاضطراب إحداث تغييرات في الجينات الأخرى المشاركة في استقلاب البروتين الدهني مثل جين APOB (البروتين الأبوي B في LDL) وجين PCSK9 (البروتين الذي يحط من مستقبلات LDL).
على الرغم من أنه من المعروف أن تراكم الكوليسترول يمكن أن يكون ضارًا ، فمن المقدر أن ما يصل إلى ثلث النوبات القلبية التي تحدث قبل سن الأربعين ناتجة عن فرط كوليسترول الدم غير المشخص أو المعالج بشكل غير لائق.
الأكثر شيوعًا هو فرط كوليسترول الدم متعدد العوامل الناجم عن عوامل بيئية (نظام غذائي غني بالدهون ، خاصة إذا كان مرتبطًا بقلة النشاط البدني) حتى في وجود عوامل وراثية مهيئة.
الأشكال التي يتجلى ارتفاع الكولسترول في العائلة نفسها
يمكن أن يظهر هذا المرض في شكلين مختلفين: شكل أقل خطورة (متغاير الزيجوت ، حالة واحدة لكل 2 فرد) والآخر أكثر خطورة (متماثل اللواقح ، حالة واحدة لكل 1 فرد) 500،1.
غالبًا ما يكون الشكل المتغاير الزيجوت بدون أعراض ويتم تشخيصه فقط بناءً على مستويات الكوليسترول في الدم.
يكافح الكبد للتخلص من LDL لأن مستقبلات LDL يتم إنتاجها بأعداد غير كافية ، مما يؤدي إلى زيادة بمقدار 2 أو 3 أضعاف في مستويات الدم مقارنة بالقيم الطبيعية.
يمكن أن يؤدي هذا الشكل إلى زيادة خطر الإصابة بأمراض القلب والأوعية الدموية في مرحلة البلوغ.
يتميز الشكل المتماثل الزيجوت بظهور أمراض القلب والأوعية الدموية حتى في سن مبكرة ووجود تراكمات مميزة للدهون مثل الورم الأصفر (عقيدات صفراء على مفاصل اليدين ووتر العرقوب) وزانثلازما (صفائح صفراء على الجفون وحولها العيون).
الخلل الجيني موروث من كلا الوالدين ، وقد لوحظ بالفعل خطر الإصابة بنوبة قلبية في غياب العلاج في سن 15-20 عامًا.
في الواقع ، في هذه الحالة ، يفشل الكبد في استقلاب البروتينات الدهنية المتبقية في الدم ، والتي تتراكم بعد ذلك مما يؤدي إلى الخلل الوظيفي الموصوف أعلاه ويخلق حالة غير متوافقة مع الحياة.
ما هي فرص انتقال المرض للأطفال؟
نظرًا لأن كل واحد منا لديه نسختان من كل جين ، كل منهما موروث من أحد الوالدين ، فسنحصل على الشكل المتغاير الزيجوت عندما نرث نسخة متغيرة وأخرى صحية.
على العكس من ذلك ، سيكون لدينا شكل متماثل الزيجوت إذا ورثنا نسختين من الجين المصاب من كلا الوالدين. يجب أن يقال إن هذا الشكل نادر جدًا لأنه يحدث فقط عندما يكون لدى كلا الوالدين الجين المسبب للمرض وبالتالي يمكن لكل منهما نقل نسخة من نفس التغيير الجيني.
يسمى فرط كوليسترول الدم العائلي بعلم الأمراض متغاير الزيجوت ويتكون في حالات نادرة حيث يتم توريث نوعين مختلفين من التغيرات الجينية ، واحد من كل والد.
يجب تشخيص الأطفال المعرضين لخطر الإصابة بالمرض وعلاجهم مبكرًا. اليوم من الممكن تشخيص المرض من خلال الاختبارات الجينية التي تبحث عن الأخطاء (التغيرات الجينية) في جينات LDLR و ApoB و PCSK9.
لذلك فقط أشكال فرط كوليسترول الدم العائلي قابلة للانتقال.
ومع ذلك ، فإن الأشكال متعددة العوامل التي تحدث بشكل أساسي بسبب نمط الحياة غير الصحيح (تراكم الكوليسترول مع النظام الغذائي) ، يمكن أيضًا أن تتميز باستعداد وراثي.
في الواقع ، قد يكون هؤلاء الأشخاص يعانون من نقص وراثي يضر بقدرة الجسم على التعويض بشكل كافٍ عن الدهون الزائدة في النظام الغذائي.
على سبيل المثال ، عندما يتشبع الكبد بالكوليسترول الذي يتم تناوله بالطعام ، قد يتم قمع إنتاج المستقبلات التي تلتقط LDL المتداول في الدم.
الوضع مشابه جدًا للحالة التي تحدث أثناء فرط كوليسترول الدم العائلي على الرغم من أنها أقل حدة.
في هذه الحالة ، يكون تركيز الكوليسترول الكلي في الدم أعلى من المعدل الطبيعي وعادة ما يكون بين 240 و 350 مجم / ديسيلتر مقارنةً بالتركيز العادي الذي يتراوح بين 200 و 240 مجم / ديسيلتر.
فضول: ربما يكون هذا المرض قد انتقل عبر القرون
تظهر الملاحظة الدقيقة للوحة الشهيرة الموناليزا احتمال أن تكون الموناليزا بالفعل في سن مبكرة تعاني من فرط كوليسترول الدم العائلي.
في الواقع ، يصور ليوناردو أيضًا بأمانة رواسب الدهون النموذجية على اليدين وبالقرب من العينين (المعروفة الآن باسم الورم الزانثوما والكسانثلازما) التي تشير إلى وجود علم الأمراض بشكل مؤكد.
إذا كان هذا صحيحًا ، فقد تبين أن فرط كوليسترول الدم العائلي هو مرض تم الحفاظ عليه على مر القرون (حالة موثقة منذ عام 1500).
ما هي احتمالات علاج هذا المرض اليوم؟
تعتمد إمكانية علاج المرض على شدته. كما أن عوامل الخطر (النظام الغذائي ، والتدخين ، والعمر ، والأسرة ، والتاريخ الشخصي لفرط كوليسترول الدم ، ووجود أمراض أخرى) يمكن أن تؤدي إلى تفاقم الصورة العامة للمرض.
لعلاج فرط كوليسترول الدم العائلي ، يمكن استخدام أدوية الجيل الجديد ، ولكن في نفس الوقت ، من الضروري العمل مع تعديل مناسب في نمط الحياة.
في حالات الشدة المتوسطة (فرط كوليسترول الدم العائلي المتغاير الزيجوت) ، العلاج الدوائي القائم على الستاتين (مثبطات تخليق الكوليسترول التي تحفز على زيادة تخليق مستقبلات LDLR) والدمج مع ezetimibe (مثبطات امتصاص الكوليسترول) أو الأدوية المثبطة لـ PCSK9 (مثل مثبطات بروتين PCSK9 التي يتمثل دورها في تدمير مستقبلات الكبد التي تلتقط LDLR) يحسن نشاط النسخة الصحية من جين LDLR ويقلل من تراكم الكوليسترول في الدم.
تمت الموافقة مؤخرًا أيضًا على حمض البيمبيدويك ، وهو دواء يعمل في الكبد عن طريق تثبيط إنزيم ATP سترات لياز ، وهو جزيء يشارك في عملية تخليق الكوليسترول الداخلي.
تسمح لنا آلية العمل هذه بالتصرف على كمية الكوليسترول المنتجة ، والعمل المنبع من موقع عمل الستاتين ، وتحفيز التعبير عن مستقبلات LDL للتعويض عن التوليف المنخفض.
على عكس الستاتين ، فإن حمض البيمبيدويك ليس نشطًا في العضلات الهيكلية ، مما يقلل من احتمالية حدوث أحداث غير مرغوب فيها نموذجية للستاتينات.
يمكن أيضًا أن يرتبط هذا الدواء بـ ezetimibe بتأثيرات إيجابية.
كان فرط كوليسترول الدم العائلي متماثل اللواقح يعتبر حتى وقت قريب مرضًا عضالًا.
العلاج المعتمد على الستاتين غير فعال في هذه الحالة المرضية. في الواقع ، لا يمكن للعقاقير المخفضة للكوليسترول التي تعمل على الآليات التي تؤدي إلى إنتاج الكوليسترول الداخلي أن تحفز تكوين مستقبلات LDL.
للتخلص من كوليسترول البروتين الدهني منخفض الكثافة من أجسام هؤلاء المرضى ، يتم إجراء فصادة البلازما ، وهي تقنية تسمح بتصفية الدم عن طريق التخلص من الدهون ، على غرار ما يتم في غسيل الكلى عندما لا تعمل الكلى.
ومع ذلك ، يعد هذا إجراءً جائرًا له تأثير سلبي على نوعية حياة المرضى.
أحدث الأبحاث حول فرط كوليسترول الدم العائلي
في السنوات الأخيرة ، أدت الأبحاث إلى تطوير عقاقير محددة أيضًا للشكل المتماثل من فرط كوليسترول الدم العائلي ، مما أدى إلى تحسن كبير في توقعات ونوعية حياة المرضى الذين يعانون منه.
على سبيل المثال ، عقار لوميتابيد lomitapide (يؤخذ عن طريق الفم) يؤدي إلى انخفاض ملحوظ في مستويات الكوليسترول الضار في البلازما لدى هؤلاء المرضى.
يثبط Lomitapide بروتين نقل الدهون الثلاثية الميكروسومي (MTP) الذي يسمح بدمج هذه الدهون مع البروتين الأبوي B100 في VLDLs الوليدة.
نتيجة لذلك ، يتم تقليل البروتين الأبوي B100 و LDL حتى في المرضى حيث تسبب المرض في الغياب التام لمستقبلات LDL.
دواء آخر من الجيل الجديد هو الميبومرسين ، وهو أليغنوكليوتيد مضاد للحساسية قادر على تحطيم البروتينات الأبوية B100 التي تشارك في تكوين LDL ، وبالتالي تقليل عدد الأخير.
Evolocumab و alirocumab هما نوعان من الأجسام المضادة وحيدة النسيلة التي تمنع نشاط بروتين PCSK9 في الدم.
ومع ذلك ، لكي يتم تفعيل هذين العقارين ، يجب أن يكون جزء صغير على الأقل من مستقبلات LDL موجودًا ويعمل.
من بين الأدوية التي لا تزال قيد التطوير السريري ، إدراج دواء بيولوجي (ما يسمى سيرنا) يمنع نسخ الحمض النووي وتخليق بروتين PCSK9 في الكبد.
تم تحقيق نتائج إيجابية مؤخرًا باستخدام evinacumab ، وهو مثبط للأجسام المضادة أحادية النسيلة للبروتين المشابه للأنجيوبويتين 3 (ANGPTL3) ، وهو جزيء يتم تصنيعه بواسطة الكبد ويتمثل دوره في زيادة مستويات الكوليسترول LLDL والدهون الثلاثية التي تمنع تدهورها.
أظهر هذا الدواء الجديد أيضًا فعاليته في المرضى الذين لا يعمل لديهم مستقبل LDL.
أجريت مؤخرًا بعض المحاولات أيضًا لفهم ما إذا كان العلاج الجيني ، مع إدخال الجين السليم في الحمض النووي للمريض ، يمكن أن ينجح.
من خلال قائمة العلاجات الممكنة لفرط كوليسترول الدم العائلي ، من الممكن فهم مقدار الأبحاث التي يتم إجراؤها لتوفير حلول لهؤلاء المرضى ، على الرغم من ندرة إصابتهم بهذا المرض الخطير ، مما يقلل من مخاطر العواقب المميتة.
ومع ذلك ، كما يحدث دائمًا مع الأدوية الجديدة ، من الجيد استخدام كلمة تحذير بشأن استخدامها المزمن لأن المعرفة بآثارها الجانبية المحتملة ستكون أوضح فقط من خلال الخبرة (التيقظ الدوائي) ، لذلك يجب تقييم استخدامها في طب الأطفال بعناية ، بالطبع مع الهدف النهائي المتمثل في منح هؤلاء المرضى "الصغار" إمكانية عيش حياة "طبيعية".
المراجع الببليوغرافية و Sitographic للمقال عن فرط كوليسترول الدم في الأسرة
1 إرشادات ESC / EAS لعام 2019 لإدارة عسر شحميات الدم: تعديل الدهون لتقليل مخاطر القلب والأوعية الدموية. المؤلفون / أعضاء فريق العمل؛ لجنة ESC لإرشادات الممارسة (CPG) ؛ جمعيات القلب الوطنية ESC. تصلب الشرايين. 2019 نوفمبر ؛ 290: 140-205. دوى: 10.1016 / j.atherosclerosis.2019.08.014.
2 خلل شحميات الدم النادر ، من النمط الظاهري إلى النمط الجيني إلى الإدارة: بيان إجماع لفريق عمل جمعية تصلب الشرايين الأوروبية. هيجل RA ، بورن J ، جينسبيرج HN ، Arca M ، Averna M ، Binder CJ ، Calabresi L ، Chapman MJ ، Cuchel M ، von Eckardstein A ، Frikke-Schmidt R ، Gaudet D ، Hovingh GK ، Kronenberg F ، Lütjohann D ، Parhofer KG ، Raal FJ، Ray KK، Remaley AT، Stock JK، Stroes ES، Tokgözoğlu L، Catapano AL. لانسيت السكري والغدد الصماء. 2020 يناير ؛ 8 (1): 50-67. دوى: 10.1016 / S2213-8587 (19) 30264-5.
3 البروتين الدهني (أ) خفض من فصادة البروتين الدهني إلى نهج قليل النوكليوتيد المضاد للحساسية. Greco MF و Sirtori CR و Corsini A و Ezhov M و Sampietro T و Ruscica MJ Clin Med. 2020 يوليو 3 ؛ 9 (7): 2103. دوى: 10.3390 / jcm9072103.
4 العلاج لخفض الكوليسترول الضار. Pirillo A، Norata GD، Catapano AL.Handb Exp Pharmacol. 2020 أبريل 30. doi: 10.1007 / 164_2020_361.
5 مراجعة العلاجات القائمة على الجينات والخلايا لفرط كوليسترول الدم العائلي. حاجي قاسمي S ، مهداوي غورابي أ ، بيانكوني الخامس ، بيرو إم ، باناك م ، أحمدي تافتي إتش ، راينر Ž ، ساهبكار فارماكول ريس. 2019 مايو ؛ 143: 119-132. دوى: 10.1016 / j.phrs.2019.03.016.



