La transplantation d'organes : en quoi consiste-t-elle, quelles en sont les étapes et ce que l'avenir nous réserve
La transplantation d'organe est l'intervention chirurgicale par laquelle un ou plusieurs organes malades (dont la fonctionnalité n'est plus récupérable) sont remplacés par un ou plusieurs organes prélevés sur un donneur (cadavérique ou vivant)
Opération qui plonge ses racines, conceptuellement, dans l'histoire la plus ancienne de l'humanité (elle a été évoquée pour la première fois par des médecins chinois), c'est pourtant une solution thérapeutique très récente : les connaissances qui l'ont rendue possible (immunologie, étude des antigènes...) acquis seulement au début du 20e siècle.
A partir de 1950, la transplantation est devenue un choix établi dans le traitement des pathologies qui conduisent à la destruction irréparable de l'organe et, par conséquent, au décès du patient.
Mais la transplantation n'est pas seulement la dernière perspective pour ceux dont la vie est en danger : cette opération permet également d'améliorer la qualité de vie des patients souffrant de maladies chroniques invalidantes (ex : transplantation rénale chez les dialysés).
L'avenir de la transplantation reste à dessiner, mais il est très clair dans l'esprit des scientifiques et des médecins engagés dans la recherche : implantation d'organes artificiels ou d'organes prélevés sur des animaux génétiquement modifiés (xénotransplantation), clonage et implantation de cellules souches ne sont que quelques exemples des directions dans lesquelles évolue le paysage scientifique mondial.
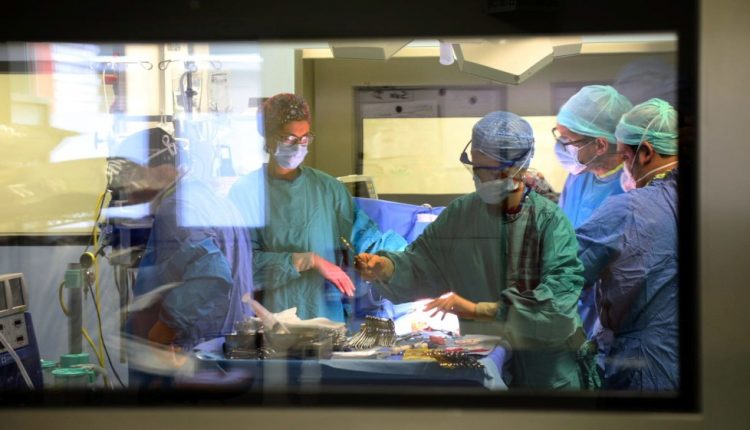
Chirurgie de transplantation d'organes
Le mot « greffe » désigne souvent, de manière réductrice, l'opération de remplacement d'un organe malade par un organe sain.
En réalité, il y a toute une organisation et une préparation derrière cette opération qui implique une extrême précision et une synchronisation des personnes et des instruments.
La pratique de l'opération diffère selon le donneur : si le prélèvement d'organe est sur une personne vivante, en effet, il est possible de planifier l'opération ; ce qui n'est évidemment pas envisageable si les organes proviennent d'un donneur cadavérique, décédé de causes accidentelles et imprévisibles.
Une fois que la commission médicale a obtenu le consentement de la famille et déclare la mort cérébrale du donneur potentiel, l'évaluation de ses données commence : compatibilité avec les receveurs potentiels inscrits sur les listes d'attente, antécédents médicaux, caractéristiques immunitaires, groupe sanguin, etc.
La transplantation d'organes se développe en plusieurs étapes
PHASE 1
Une personne présentant des blessures qui pourraient être un donneur (par exemple, un traumatisme crânien très grave) est admise en soins intensifs.
Un médecin parle à la famille de la possibilité de faire don de ses organes ; s'ils sont disponibles, le centre de coordination est immédiatement alerté, qui se charge de signaler le donneur potentiel et d'identifier le receveur potentiel.
Parallèlement, les données du patient donneur sont évaluées : compatibilité avec les receveurs potentiels de la liste, antécédents médicaux, caractéristiques immunitaires. La période d'observation de 6 heures commence, qui est obligatoire avant la certification de la mort cérébrale.
PHASE 2
L'équipe d'explantation est activée et doit être disponible dans un délai très court.
Les médecins se rendent généralement à l'établissement par hélicoptère. Pendant ce temps, à l'hôpital où la greffe sera effectuée, le receveur est convoqué pour subir divers examens et évaluer son état de santé.
De nombreux contrôles sont également effectués sur les organes à donner pour éviter la transmission de maladies infectieuses ou de tumeurs du donneur au receveur.
PHASE 3
A la fin de la période d'observation, si toutes les indications orientent vers un diagnostic de mort cérébrale irréversible, l'explantation peut commencer (environ 2 heures).
Le receveur entre dans la salle d'opération et se prépare pour l'opération. L'administration de médicaments immunosuppresseurs commence maintenant pour empêcher les lymphocytes de reconnaître l'organe comme étranger et de provoquer un rejet.
PHASE 4
L'organe arrive enfin, plongé dans une solution spéciale pour protéger ses cellules et transporté dans un récipient spécial rempli de glace pour ralentir son activité cellulaire.
Une équipe de médecins prépare le receveur, l'autre s'occupe du nettoyage de l'organe à greffer.
PHASE 5
La greffe peut alors commencer : les vaisseaux sanguins sont reliés, le saignement est contrôlé.
ÉTAPE 6
Le patient sort du bloc opératoire, mais est toujours sous anesthésie, qui sera prolongée d'au moins 6 à 8 heures supplémentaires pour permettre au nouvel organe de s'habituer à la différence de température entre le récipient contenant la glace et le corps et, bien sûr, à l'organe lui-même.
Le patient reste connecté à la machine pour respirer.
ÉTAPE 7
Le patient se réveille aux soins intensifs ; si son état général est bon, il est retiré du respirateur artificiel.
Après environ 4 jours, il recommence à marcher et à manger.
Après environ 10 jours, il pourra quitter l'hôpital et vivre avec son nouvel organe.
Dans un premier temps, il devra retourner à l'hôpital tous les jours pour des contrôles immunologiques ; après un an, il pourra revenir une fois tous les deux mois.
Prélèvement d'organes
Une fois la mort cérébrale constatée et le consentement de la famille obtenu (en cas d'absence de volonté explicite du donneur), le donneur potentiel n'est plus assisté par le respirateur mécanique et les organes peuvent être prélevés pour la transplantation dans le même hôpital qui a établi l'aptitude .
L'équipe préalablement alertée entre dans le bloc opératoire pour l'opération d'évacuation.
S'opposer au retrait ne signifie jamais aider le patient à être mieux soigné ; les soins, en fait, cessent au moment où la mort cérébrale est établie ; s'y opposer reviendrait donc seulement à priver quelqu'un d'une vie meilleure grâce à un nouvel organe.
Aujourd'hui, un autre type de greffe gagne également du terrain, celui de personnes vivantes.
En effet, il est désormais possible de prélever un rein, un foie ou un lobe pulmonaire pour une greffe chez des personnes particulièrement à risque qui ne survivraient pas sur la liste d'attente.
Il s'agit généralement d'enfants, à la fois en raison de la pénurie d'organes de transplantation pédiatrique et en raison de la petite taille, ce qui signifie également que le donneur ne court pas un risque trop élevé.
Une fois prélevés, les organes nécessitent des procédures spéciales pour les conserver en vue de la transplantation.
Il existe, pour chaque organe, une durée de conservation maximale, au-delà de laquelle les tissus, ne recevant plus de sang, et donc d'oxygène, se nécrose, c'est-à-dire que leurs cellules meurent, et sont donc inutilisables.
Ces délais varient d'un organe à l'autre : cœur (4-6 heures), poumon (4-6 heures), foie (12-18 heures), rein 48-72 heures, pancréas (12-24 heures).
Transplantation d'organe : rejet
Le rejet est la réaction de l'organisme receveur envers l'organe ou le tissu greffé.
En fait, le système immunitaire du receveur reconnaît l'organe comme étranger et l'attaque comme s'il s'agissait d'un agent pathogène.
Il existe quatre types de refus
- le rejet suraigu : c'est le plus rapide et survient en quelques minutes ou quelques heures après la greffe ;
- rejet accéléré : survient souvent chez les patients ayant déjà reçu une greffe antérieure et survient 3 à 4 jours après l'opération ;
- rejet aigu : survient après un laps de temps allant de 5 à 90 jours ; les symptômes spécifiques sont l'œdème, la fièvre et la perte de fonction de l'organe transplanté ;
- rejet chronique : se développe environ 3 mois après la transplantation et peut endommager les tissus du nouvel organe jusqu'à la perte de fonction.
Vivre le rejet de l'organe greffé ne signifie pas nécessairement le perdre inévitablement ; au contraire, le rejet est traité avec succès si des mesures sont prises dans un délai raisonnable grâce à l'utilisation de médicaments immunosuppresseurs.
Les immunosuppresseurs que le médecin prescrit après la greffe aideront l'organe greffé à ne pas risquer de rejet et à rester en bonne santé.
Étant donné que les cellules du système immunitaire sont différentes, les médicaments prescrits pour l'immunosuppression seront également différents.
Indications et contre-indications à la transplantation d'organes
L'indication la plus importante et la plus immédiate de transplantation est la défaillance irréversible d'organes vitaux tels que les reins, le foie, les poumons, le pancréas, mais aussi les cornées, la moelle osseuse, les intestins.
En effet, dans ces cas, la greffe est le seul traitement efficace pour assurer la survie.
Par conséquent, toute condition pathologique qui empêche l'organe de fonctionner de manière à menacer la survie du patient doit être considérée comme une indication de transplantation.
Soins postopératoires
Après la greffe, les receveurs sont admis les premiers jours dans un service équipé pour les soins intensifs, où un traitement immunosuppresseur est instauré.
Le patient immunodéprimé nécessite un isolement dans des chambres « stériles », spécialement aménagées pour éviter toute contamination de l'extérieur.
La « box » dans laquelle le receveur est admis après l'opération de greffe est complètement isolée du reste de l'unité de réanimation utilisée pour la chirurgie conventionnelle.
La condition d'isolement strict persiste aussi longtemps qu'il faut au patient pour surmonter la phase critique post-chirurgicale (généralement 5-6 jours), ou dans les cas où une thérapie anti-rejet est nécessaire.
Visites aux patients transplantés
Dans la période postopératoire immédiate, les visites aux proches sont autorisées à condition qu'ils soient convenablement habillés (selon les procédures d'entrée en salle blanche).
Chaque personne est admise dans la zone de filtrage une à la fois et, bien sûr, les personnes suspectées et/ou présentant des signes de maladies infectieuses peuvent ne pas être admises.
Développements futurs
Les problèmes les plus graves en médecine de transplantation sont, d'une part, le rejet de l'organe greffé et, d'autre part, l'insuffisance d'organes donnés par rapport aux besoins.
Dans les deux sens, la recherche expérimente diverses solutions pour pallier ces problèmes.
En ce qui concerne le rejet, on cherche à créer des solutions qui parviennent à tromper le système immunitaire, réduisant ainsi la thérapie immunosuppressive actuellement utilisée, ou qui protègent l'organe greffé de l'attaque des lymphocytes T, responsables de l'élimination d'agents extérieurs à l'organisme. .
D'un autre côté, celui de la pénurie d'organes, on expérimente des organes artificiels, l'ingénierie tissulaire ou la xénotransplantation qui peuvent remplacer les organes humains.
Thérapie génique
Grâce à la thérapie génique, il est possible d'aller à la source du problème et d'éliminer les défauts génétiques directement dans les cellules, tissus ou organes affectés.
Le gène sain est introduit directement dans l'endroit affecté, où il commence à produire les substances que le corps malade ne peut pas produire par lui-même.
Cependant, la thérapie génique est encore loin d'être utilisée. Afin de pouvoir transporter de l'ADN étranger dans le noyau cellulaire, des « vecteurs » spéciaux sont nécessaires – des virus qui ont perdu leurs caractéristiques infectieuses, mais qui sont toujours capables d'attaquer les cellules et de leur transmettre leur patrimoine génétique.
Pour éviter le rejet, l'organe à greffer devrait être traité en laboratoire, en lui transférant des gènes qui le rendraient capable de se défendre contre le système immunitaire du receveur.
Désormais, les gènes sont connus, mais ils ne sont pas encore manipulés avec la précision nécessaire. La prochaine étape consistera à rechercher la combinaison parfaite de gènes qui empêche l'action de tous les mécanismes immunologiques du receveur.
Création de tissus
Le but de ce type de thérapie est de trouver une alternative aux organes humains.
Déjà maintenant, les chercheurs sont capables de produire en laboratoire des tissus tels que des vaisseaux sanguins, des valves cardiaques, du cartilage et de la peau.
Il a été possible de franchir cette nouvelle frontière grâce au fait que les cellules ont tendance à s'agréger pour former des organes et des tissus.
Cellules souches
Les cellules souches sont les cellules indifférenciées trouvées dans les embryons humains une semaine après la fécondation.
Ce sont aussi les cellules « de départ » à partir desquelles se développeront les tissus et les organes de l'enfant à naître.
Leur fonction est de réguler le renouvellement des cellules sanguines (globules rouges, globules blancs et plaquettes) et celles du système immunitaire (lymphocytes).
Aujourd'hui, des machines informatisées, des séparateurs, sont utilisées pour collecter ces cellules, permettant la sélection des cellules nécessaires. Les receveurs des cellules sont des patients souffrant de maladies de la peau, de maladies du sang ou de tumeurs solides.
Outre le fait que les cellules souches sont encore largement méconnues, se pose également un problème éthique : la récolte de cellules souches embryonnaires implique la mort de l'embryon.
C'est pourquoi la manière de récolter les cellules souches des adultes est en train d'être perfectionnée.
Clonage
La technique du clonage permettrait de contourner complètement le problème du rejet d'organe.
Il s'agirait d'introduire le noyau cellulaire du patient, avec tout son patrimoine génétique, dans la cellule souche d'un embryon ou d'un ovocyte humain qui n'avait auparavant pas de noyau propre.
Cultivées in vitro en laboratoire, ces cellules modifiées seraient génétiquement identiques à celles du système immunitaire du patient, qui ne les reconnaîtrait pas comme étrangères.
Cette technique n'est pas une option viable à l'heure actuelle car le clonage, la récolte de cellules souches et l'utilisation aveugle des ovocytes sont interdits par la loi.
Xénotransplantation
La xénotransplantation, c'est-à-dire la transplantation de cellules animales, de tissus et d'organes chez l'homme, semble être la solution d'avenir à la pénurie d'organes destinés à la transplantation.
Les expériences dans ce domaine sont nombreuses et se heurtent à des problèmes éthiques, psychologiques et, last but not least, immunitaires.
Les quelques tentatives qui ont été faites, en effet (un foie de porc et un cœur de babouin transplantés sur deux êtres humains différents) n'ont pas donné les résultats escomptés.
La crise du rejet, en effet, a été particulièrement violente et incontrôlable.
Pourtant, cette technique pourrait bien être la solution à la pénurie d'organes.
En effet, ce qui est le plus redouté, c'est le développement d'infections typiquement animales, transmises à l'homme via des pathogènes présents dans l'organe à greffer, qui pourraient s'avérer désastreuses.
Une alternative possible à ce handicap pourrait être des modifications génétiques sur des animaux donneurs ; en pratique, les animaux seraient élevés dans un environnement stérile et génétiquement modifiés pour rendre leurs organes plus compatibles avec l'organisme du receveur.
Pour l'instant, cependant, certaines étapes ont été franchies; il s'agit de xénotransplantations de cellules et non de xénotransplantations d'organes, telles que des cellules d'embryon de porc pour le traitement de la maladie de Parkinson, des cellules de moelle de babouin transplantées chez des patients atteints du SIDA en phase terminale dans le but de rétablir le système immunitaire des patients, ou des insulae de pancréas provenant encore de porcs en phase de stimulation de la production d'insuline comme traitement contre le diabète.
Transplantation d'organes : organes artificiels
Une autre solution à la défaillance d'un organe comme le rejet est les organes artificiels.
Le principal problème est la compatibilité biologique; ce sont, après tout, des organes mécaniques qui doivent s'adapter à un organisme biologique.
La biocompatibilité doit couvrir toutes les caractéristiques morphologiques, physiques, chimiques et fonctionnelles capables d'assurer la fonctionnalité de l'organe et, en même temps, sa survie sans risque de rejet.
Ce sont toutes ces implications qui rendent complexe la production d'organes artificiels capables de remplacer complètement et parfaitement les organes « naturels » dans leurs fonctions.
Lire aussi:
Transplantation d'organes : diagnostic et prise en charge des patients en attente
Qu'est-ce que la transplantation cardiaque? Un aperçu
Comment se déroule une greffe de visage ? - VIDÉO



