Трансплантация органов: из чего состоит, какие есть этапы и что ждет в будущем
Трансплантация органов — это хирургическая процедура, при которой один или несколько больных органов (чья функциональность больше не восстанавливается) заменяются одним или несколькими органами, взятыми у донора (трупного или живого).
Операция, концептуально уходящая своими корнями в самую раннюю историю человечества (о ней впервые заговорили китайские врачи), тем не менее, является очень недавним терапевтическим решением: знания, которые сделали ее возможной (иммунология, изучение антигенов…), были приобрел только в начале 20 века.
С 1950 г. трансплантация стала устоявшимся методом лечения тех патологий, которые приводят к необратимому разрушению органа и, следовательно, к смерти больного.
Но трансплантация — это не только последняя перспектива для тех, чья жизнь находится в опасности: эта операция также позволяет улучшить качество жизни пациентов, страдающих хроническими инвалидизирующими заболеваниями (например, трансплантация почки для диализных больных).
Будущее трансплантологии еще предстоит обрисовать, но оно уже совершенно ясно в умах ученых и врачей, занимающихся исследованиями: имплантация искусственных органов или органов, взятых у генетически модифицированных животных (ксенотрансплантация), клонирование и имплантация стволовых клеток — это лишь некоторые из них. направлений, в которых движется мировой научный ландшафт.
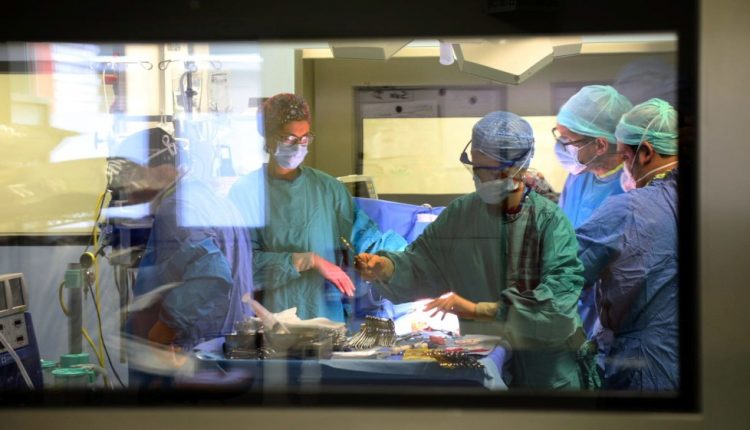
Операция по пересадке органов
Слово «трансплантация» часто в редуктивном смысле означает операцию по замене больного органа здоровым.
На самом деле за этой операцией стоит целая организация и подготовка, требующая предельной точности и синхронизации людей и инструментов.
Практика операции различается в зависимости от донора: если забор органа у живого человека, то фактически можно планировать операцию; что, очевидно, невозможно, если органы получены от трупного донора, умершего по случайным и непредвиденным причинам.
После того, как медицинская комиссия получила согласие семьи и констатировала наступившую смерть мозга потенциального донора, начинается оценка его данных: совместимость с потенциальными реципиентами в листах ожидания, история болезни, иммунные характеристики, группа крови и т.д.
Трансплантация органов проходит несколько этапов
ФАЗА 1
Человека с травмами, которые могли бы быть донорскими (например, очень тяжелая травма головы), госпитализируют в реанимацию.
Врач беседует с семьей о возможности пожертвования своих органов; если они доступны, немедленно оповещается координационный центр, который отвечает за сообщение о потенциальном доноре и идентификацию потенциального реципиента.
При этом оцениваются данные пациента-донора: совместимость с потенциальными реципиентами по списку, история болезни, иммунные характеристики. Начинается 6-часовой период наблюдения, обязательный перед констатацией смерти мозга.
ФАЗА 2
Команда эксплантации активизирована и должна быть доступна в очень короткое время.
Врачи обычно добираются до учреждения на вертолете. Тем временем в больнице, где будет проводиться трансплантация, реципиента вызывают для прохождения различных обследований и оценки состояния его здоровья.
Также проводятся многочисленные проверки органов, подлежащих донорству, для предотвращения передачи инфекционных заболеваний или опухолей от донора к реципиенту.
ФАЗА 3
В конце периода наблюдения, если все признаки указывают на диагноз необратимой смерти головного мозга, можно начинать эксплантацию (примерно через 2 часа).
Реципиент входит в операционную и готовится к операции. Введение иммунодепрессантов начинается уже сейчас, чтобы предотвратить распознавание лимфоцитами органа как чужеродного и вызвать отторжение.
ФАЗА 4
Наконец прибывает орган, погруженный в специальный раствор для защиты его клеток и транспортируемый в специальном контейнере, наполненном льдом, чтобы замедлить его клеточную активность.
Одна команда врачей готовит реципиента, другая занимается очисткой органа для пересадки.
ФАЗА 5
Теперь можно начинать трансплантацию: кровеносные сосуды соединены, кровотечение остановлено.
ШАГ 6
Пациент выходит из операционной, но все еще находится под анестезией, которая будет продлена как минимум еще на 6-8 часов, чтобы дать новому органу возможность привыкнуть к разнице температур между контейнером со льдом и телом и, конечно, к самому органу.
Пациент остается подключенным к аппарату для дыхания.
ШАГ 7
Больной просыпается в реанимационном отделении; если общее состояние хорошее, его снимают с аппарата искусственной вентиляции легких.
Примерно через 4 дня он снова начинает ходить и есть.
Примерно через 10 дней он сможет покинуть больницу и жить со своим новым органом.
Первоначально ему придется каждый день возвращаться в больницу для иммунологического обследования; через год он сможет возвращаться раз в два месяца.
Удаление органов
После констатации смерти мозга и получения согласия семьи (в случае отсутствия явных пожеланий донора) потенциальному донору больше не помогает механический респиратор, и органы могут быть взяты для трансплантации в той же больнице, которая установила пригодность. .
Предварительно предупрежденная бригада входит в операционную для операции по удалению.
Противодействие удалению никогда не означает помощь пациенту в обеспечении лучшего ухода; забота, по сути, заканчивается в тот момент, когда констатируется смерть мозга; противодействовать ему, следовательно, означало бы лишь лишить кого-то лучшей жизни благодаря новому органу.
Сегодня набирает популярность и другой тип трансплантации — от живых людей.
Действительно, теперь можно взять почку, печень или долю легкого для трансплантации у людей из группы риска, которые не выживут в списке ожидания.
Обычно это дети, как из-за нехватки педиатрических органов для трансплантации, так и из-за небольшого размера, что также означает, что донор не подвергается слишком высокому риску.
После взятия органов требуются специальные процедуры для их сохранения для трансплантации.
Для каждого органа существует максимальное время консервации, по истечении которого ткани, не получающие больше крови, а следовательно, и кислорода, вступают в некроз, т. е. их клетки отмирают и поэтому становятся непригодными.
Это время варьируется от органа к органу: сердце (4-6 часов), легкие (4-6 часов), печень (12-18 часов), почки 48-72 часа, поджелудочная железа (12-24 часа).
Трансплантация органов: отторжение
Отторжение – это реакция организма-реципиента на пересаженный орган или ткань.
Фактически иммунная система реципиента распознает орган как чужеродный и атакует его, как если бы он был патогеном.
Существует четыре типа отказа
- сверхострое отторжение: наиболее быстрое и возникает в течение нескольких минут или часов после трансплантации;
- ускоренное отторжение: часто возникает у пациентов, которым уже был ранее проведен трансплантат, и возникает через 3-4 дня после операции;
- острое отторжение: возникает через период времени от 5 до 90 дней; специфическими симптомами являются отек, лихорадка и потеря функции трансплантированного органа;
- хроническое отторжение: развивается примерно через 3 месяца после трансплантации и может вызвать повреждение тканей нового органа вплоть до потери функции.
Отторжение пересаженного органа не обязательно означает его неизбежную потерю; напротив, отторжение успешно лечится, если принять меры в разумные сроки с помощью иммунодепрессантов.
Иммунодепрессанты, которые назначает врач после трансплантации, помогут пересаженному органу не рисковать отторжением и оставаться здоровым.
Так как клетки иммунной системы разные, то и препараты, назначаемые для иммуносупрессии, тоже будут разными.
Показания и противопоказания к пересадке органов
Самым большим и непосредственным показанием к трансплантации является необратимая недостаточность жизненно важных органов, таких как почки, печень, легкие, поджелудочная железа, а также роговица, костный мозг, кишечник.
Действительно, в этих случаях трансплантация является единственным эффективным методом лечения, обеспечивающим выживание.
Поэтому любое патологическое состояние, препятствующее функционированию органа таким образом, что это угрожает выживанию пациента, должно рассматриваться как показание к трансплантации.
Послеоперационный уход
После трансплантации реципиентов первые несколько дней госпитализируют в палату, оборудованную для интенсивной терапии, где начинают иммуносупрессивную терапию.
Больной с ослабленным иммунитетом нуждается в изоляции в «стерильных» помещениях, специально созданных для предотвращения любого рода контаминации из внешней среды.
«Бокс», в который помещают реципиента после операции по трансплантации, полностью изолирован от остальной части реанимационного отделения, используемого для обычной хирургии.
Состояние строгой изоляции сохраняется до тех пор, пока больной преодолевает критическую послеоперационную фазу (обычно 5-6 дней), или в тех случаях, когда требуется антиотторженческая терапия.
Посещение пациентов с трансплантацией
В ближайшем послеоперационном периоде разрешены посещения близких родственников при условии, что они одеты соответствующим образом (в соответствии с процедурами входа в чистые помещения).
Каждый человек допускается в зону фильтрации по одному и, естественно, лица с подозрением и/или признаками инфекционных заболеваний не допускаются.
Будущие разработки
Наиболее серьезными проблемами в трансплантологии являются, с одной стороны, отторжение пересаженного органа, а с другой – недостаточность донорских органов по сравнению с необходимыми.
В обоих направлениях исследования экспериментируют с различными решениями для преодоления этих проблем.
Что касается отторжения, предпринимаются попытки создать решения, которые могут обмануть иммунную систему, тем самым снижая иммуносупрессивную терапию, используемую в настоящее время, или которые защищают пересаженный орган от атаки Т-лимфоцитов, которые отвечают за элиминацию агентов вне организма. .
На другом фронте, связанном с нехваткой органов, проводятся эксперименты с искусственными органами, тканевой инженерией или ксенотрансплантацией, которые могут заменить человеческие органы.
Генная терапия
С помощью генной терапии можно добраться до источника проблемы и устранить генетические дефекты непосредственно в пораженных клетках, тканях или органах.
Здоровый ген внедряется непосредственно в пораженное место, где он начинает вырабатывать те вещества, которые больной организм не может производить самостоятельно.
Однако генная терапия все еще далека от применения. Для того чтобы иметь возможность транспортировать чужеродную ДНК в ядро клетки, нужны особые «переносчики» — вирусы, утратившие свои инфекционные свойства, но все еще способные атаковать клетки и передавать им свое генетическое наследие.
Чтобы избежать отторжения, пересаживаемый орган необходимо будет обработать в лаборатории, перенеся в него гены, которые сделают его способным защищаться от иммунной системы реципиента.
Теперь гены известны, но с ними еще не обращаются с необходимой точностью. Следующим шагом будет поиск идеального сочетания генов, предотвращающего действие всех иммунологических механизмов реципиента.
Тканевая техника
Целью этого вида терапии является поиск альтернативы человеческим органам.
Уже сейчас исследователи могут производить в лаборатории такие ткани, как кровеносные сосуды, сердечные клапаны, хрящи и кожу.
Преодолеть этот новый рубеж удалось благодаря тому факту, что клетки склонны объединяться в органы и ткани.
Стволовые клетки
Стволовые клетки — это недифференцированные клетки, обнаруживаемые в эмбрионах человека через неделю после оплодотворения.
Они также являются «стартовыми» клетками, из которых разовьются ткани и органы будущего ребенка.
Их функция заключается в регуляции оборота клеток крови (эритроцитов, белые клетки крови и тромбоциты) и иммунной системы (лимфоциты).
Сегодня для сбора этих клеток используются компьютеризированные машины, сепараторы, позволяющие выделить нужные клетки. Реципиентами клеток являются пациенты, страдающие кожными заболеваниями, болезнями крови или солидными опухолями.
Помимо того, что стволовые клетки до сих пор в значительной степени неизвестны, существует еще и этическая проблема: сбор эмбриональных стволовых клеток подразумевает смерть эмбриона.
Вот почему способ получения стволовых клеток у взрослых людей совершенствуется.
Клонирование
Техника клонирования позволила бы вообще обойти проблему отторжения органов.
Это будет включать введение клеточного ядра пациента со всем его генетическим наследием в стволовую клетку человеческого эмбриона или ооцита, которые ранее не имели собственного ядра.
Выращенные in vitro в лаборатории, эти модифицированные клетки будут генетически идентичны клеткам иммунной системы пациента, которая не распознает их как чужеродные.
Этот метод в настоящее время не является жизнеспособным вариантом, поскольку клонирование, сбор стволовых клеток и неизбирательное использование ооцитов запрещены законом.
ксенотрансплантация
Ксенотрансплантация, т.е. трансплантация животных клеток, тканей и органов людям, кажется будущим решением проблемы нехватки органов для трансплантации.
Эксперименты в этой области многочисленны и сталкиваются с этическими, психологическими и, что не менее важно, иммунными проблемами.
Несколько предпринятых попыток (пересадка печени свиньи и сердца бабуина двум разным людям) не дали желаемых результатов.
Кризис отторжения, по сути, был особенно сильным и не поддающимся контролю.
Тем не менее, этот метод действительно может быть решением проблемы нехватки органов.
На самом деле больше всего опасаются развития типичных для животных инфекций, передающихся человеку через патогены, присутствующие в трансплантируемом органе, что может иметь катастрофические последствия.
Возможной альтернативой этому недостатку могут быть генетические модификации животных-доноров; на практике животных будут разводить в стерильной среде и генетически модифицировать, чтобы сделать их органы более совместимыми с организмом реципиента.
Однако на данный момент достигнуты некоторые вехи; это клеточные ксенотрансплантаты, а не ксенотрансплантаты органов, такие как клетки эмбрионов свиней для лечения болезни Паркинсона, клетки костного мозга бабуинов, трансплантированные неизлечимо больным СПИДом в попытке восстановить иммунную систему пациентов, или островки поджелудочной железы свиней при стимуляции. выработки инсулина в качестве терапии диабета.
Трансплантация органов: искусственные органы
Другим решением отказа органа, такого как отторжение, являются искусственные органы.
Основная проблема — биологическая совместимость; ведь это механические органы, которые должны приспосабливаться к биологическому организму.
Биосовместимость должна охватывать все морфологические, физические, химические и функциональные характеристики, способные обеспечить функциональность органа и в то же время его выживаемость без риска отторжения.
Именно все эти последствия делают сложным производство искусственных органов, способных полностью и совершенно заменить «естественные» органы по их функциям.
Читайте также:
Трансплантация органов: диагностика и уход за ожидающими пациентами
Что такое трансплантация сердца? Обзор
Как выполняется пересадка лица? - ВИДЕО



