Prueba según COVID-19, le indicazioni del Ministero della Salute ai medici italiani: ecco quali usare e perché
Test según COVID-19, il Ministero della Salute ha diffuso il documento "Test di laboratorio per SARS-CoV-2 e loro uso in sanità pubblica", contente indicazioni sui criterioi di scelta dei test a disposizione, per un uso razionale e sostenibile delle risorse nei diversi contesti.
E 'il documento di riferimento per i medici italiani, e viene diffuso in Pdf da Fnomceo, la Federazione degli Ordini dei Medici e degli Odontoiatri italiani.
Perché nel mezzo della seconda ondata dell'epidemia di coronavirus, è essenziale la scelta dei test a disposizione nei diversi contesti per un uso razionale e sostenibile delle risorse.
Questo documento riassume le informazioni disponibili al momento della sua pubblicazione e può essere aggiornato se ulteriori evidenze Scientifiche saranno disponibili.
Prueba COVID-19, le indicazioni de la OMS
Le indicazioni riportate in questo documento sono in line con le indicazioni riportate dalla Organización Mundial de la Salud (OMS) per i profili dei prodotti per diagnostica che hanno come target COVID-19 così come riportati nel documento “Perfiles de productos objetivo para diagnósticos prioritarios para respaldar la respuesta a la pandemia COVID19 v.1.0 ”del 28 de septiembre de 2020 che descrivono le caratteristiche principali dei test per SARS-CoV-2, ma che sottolineano anche la needità che essi soddisfino non solo i criteria di specificità e sensibilità, ma anche caratteristiche di test rapido che ne favorisca l'uso in determinati contesti.
Lo Centro Europeo para la Prevención y el Control de Enfermedades (ECDC) riconosce 5 obiettivi per il testing: controllare la trasmissione;
monitorare l'incidenza, l'andamento e valutare la gravità nel tempo;
mitigare l'impatto del COVID-19 nelle strutture sanitarie e socioassistenziali;
rilevare cluster o focolai in contesti Specifici;
prevenire la (re) introduzione nelle aree che hanno raggiunto un controllo sostenuto del virus.
Pruebo COVID-19 actualmente disponibili per scopi di sanità pubblica
Actualmente pruebo possono essere suddivisi en tre grandi gruppi: tampone molecolare, tampone antigenico rapido, test sierologici.
COVID-19, il prueba molecular mediante tampón
Si tratta di una indagine molecolare reverse transcription (rt) -Real Time PCR per la rilevazione del genoma (RNA) del virus SARS-CoV-2 nel campione biologico.
Questa metodica permette di identificare in modo altamente specifico e sensibile uno o más geni bersaglio del virus presenti nel campione biologico e di misurare in tempo real la concentrazione iniziale della sequenza target.
I saggi in rt-Real Time PCR, seppur con indicazioni cualitativa così come descritti e suggeriti dagli organi internazionali di riferimento, permettono di ottenere una curva di amplificazione il cui Cycle Threshold o ciclo soglia (CT) è inversamente proporzionale alla quantità genico del bersaglio stampo iniziale presente nel campione.
Quindi, en base a questo principio, maggiore è il numero delle “molecole stampo” presenti all'inizio della reazione e minore sarà il numero di cicli needari per raggiungere un determinato valore di CT.
Viceversa, un alto valor de CT, otros dopo numerosi cicli di amplificazione, indica una bassa quantità di target genico iniziale e quindi di genoma virale. La rt-Real Time PCR es el "estándar de oro" según el diagnóstico de COVID-19.
La rilevazione dell'RNA virale di SARS-CoV-2 eseguita in laboratorio da campioni clinici (in genere tamponi nasofaringei o orofaringei) ad oggi rimane il saggio di riferimento internazionale per sensibilità e specificità ed è in grado di rilevare il patogeno anche a bassa carica virale in soggetti sintomatici, pre-sintomatici o asintomatici.
Per la complessità della metodica, la rilevazione di SARS-CoV-2 viene eseguita esclusivamente en laboratori specializzati con operatori esperti (5).
El resultado puede ser ottenuto en un mínimo de 3-5 o más situaciones organizativas y logísticas que pueden enriquecerse incluso entre 1 y 2 días.
È necessario ricordare che ai fini della segnalazione dei casi nel sistema della sorveglianza integrata COVID-19, coordinata da ISS, vengono considerati solo i risultati positivi ottenuti tramite rt-Real Time PCR dai laboratori di riferimento regionali o dai laboratori identificati / autorizzati dai https://www.epicentro.iss.it/coronavirus/sars-cov-2- sorveglianza).
Si aggiunge la possibilità di effettuare l'analisi dei test molecolari senza effettuare l'estrazione e la purificazione dell'RNA dal campione biologico, ma di utilizzare la tecnica della inattivazione al calore (95 ° C / 98 ° C) ("a crudo" ).
Ciò permette di semplificare, massimizzare e velocizzare il primo step dell'analisi stessa, especialmente en condizioni di forte pressione sui laboratori dovuti all'aumentare dei tamponi da processare.
Il rischio di perdita di sensibilità può considerarsi minimo e present solo ad alti numeri di cicli di amplificazione della PCR, come riportato da lavori scientifici internazionali (6-7).
Sin embargo, la sensibilidad risulta essere superiore al test antigenico.
Prueba antigenico rapido (mediante tampone nasale, naso-oro-faringeo, salivare) por il Covid-19
Negli ultimi mesi, sono stati sviluppati nuovi tipi di test che promettono di offrire risultati più rapidamente (30-60 minuti), con menor costo e senza la needità di personale specializzato (8).
Questi sono i test antigenici rapidi, strumenti potencialmente utili soprattutto per le indagini di screening.
Analogamente ai test molecolari, i saggi antigenici sono di tipo diretto, ossia valutano direttamente la presenza del virus nel campione clinico, a differenza dei test sierologici che sono di tipo indiretto, cioè rilevano la presenza di anticorpi specifici che indicano una infezione pregressa o in at at at .
A differenza dei test molecolari, però, i test antigenici rilevano la presenza del virus non tramite il suo acido nucleico ma tramite le sue proteine (antigeni).
Questi test contengono come substrato anticorpi specifici in grado di legarsi agli antigeni virali di SARS-CoV-2 ed il risultato della reazione antigene-anticorpo può essere direttamente visible a occhio nudo o letto mediante una semplice apparecchiatura al "point of care" senza la needità di essere effettuato in un laboratorio.
Negli Stati Uniti 3 prueba antigenici rapidi sono stati autorizzati da FDA. En Europa, numerosi test hanno già ottenuto il marca CE e diversas aziende di diagnostica stanno lavorando per ottenere l'approvazione normativa idonea per essere immessi sul mercato con un suficiente grado di affidabilità (9).
Pruebo antigenici sono di tipo qualitativo (sì / no) e intercettano, tramite anticorpi policlonali o monoclonali, specifici peptidi (porzioni proteiche) della proteina S (Spike) o N (nucleocapside) presenti sulla superficie virale di SARS-CoV-2.
Il test può risultare negativo se la concentrazione degli antigeni è inferiore al limite di rilevamento del test (es. Se il prelievo è stato eseguito troppo precocemente rispetto all'ipotetico moment di esposizione) o se il campione è stato prelevato, trasportato o conservato impropriamente.
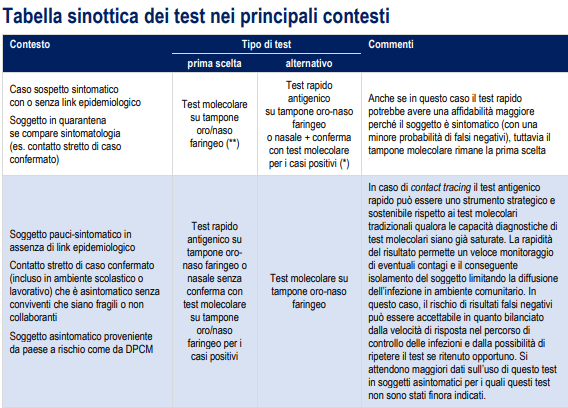
Per questo, i produttori di tali kit evidenziano che un risultato negativo del test non esclude la possibilità di un'infezione da SARS-CoV-2 e la negatività del campione, a fronte di forte sospetto di COVID-19, dovrebbe essere confermata mediante test molecolare.
Pruebo molecolari sembrano avere una maggiore sensibilità prima della comparsa dei sintomi, mentre nella fase iniziale inmediatamente sucesiva all'inizio dell'infezione i test rapidi antigenici e quelli molecolari hanno una sensibilità simile, rendendo utile l'uso anche dei primi (2).
Inoltre, il test rapido antigenico può essere utilizzato per l'identificazione dei contatti asintomatici dei casi, anche se questo tipo di test non è specificamente autorizzato per questa destinazione d'uso, poiché è stato dimostra che i casi asintomatici hanno cariche virali simili ai casi sintomatici (10).
Purtroppo, fino ad oggi non vi sono enoughi studi pubblicati che, a fronte di contesti specifici e di una ampia casistica, forniscano indicazioni sulla sensibilità e specificità di questi test rapidi.
Allo stato attuale, i dati disponibili dei vari test per questi parametri sono quelli dichiarati dal produttore: 70-86% per la sensibilità y 95-97% per la specificità (11-14)
La Foundation for Innovative New Diagnostics (FIND) (https://www.finddx.org/covid19/pipeline/?section=show-all#diag_tab) ha creato una piattaforma online in rapida evoluzione che raccoglie una vasta serie di saggi per SARS -CoV-2 che vanno dalle prime fasi di sviluppo fino alla piena Approvazione normativa.
Riguardo i test su tampone salivare, il dispositivo di rilevazione è lo stesso, ma cambiando il campione analizzato possono changee le caratteristiche di sensibilità e specificità del test.
En conclusión, la sensibilità e la specificità di questi test antigenici rapidi dovranno essere valutate per i loro valori predittivi nel corso del loro sviluppo tecnologico.
È importante la condivisione dei dati a livello locale / regionale / nazionale delle validazioni su vari tipi di test antigenici rapidi, inclusive quelli salivari, in commercio nel nostro paese.
Pruebas serológicas
Pruebo sierologici rilevano l'esposizione al virus SARS-COV-2 ma non sono en grado di confermare o meno una infezione in atto.
Per questo, in case di positività si necessita di un test molecolare su tampone per conferma.
Come da circolare del Ministero della Salute 16106 del 9 maggio 2020, si ribadisce che “la qualità e l'affidabilità di un test dipendono in particolare dalle due caratteristiche di specificità e sensibilità, e pertanto, sebbene non sussistano in relazione ad esse obblighi di leg. , è fortemente raccomandato l'utilizzo di test del tipo CLIA e / o ELISA che abbiano una specificità non inferiore al 95% e una sensibilità non inferiore al 90%, al fine di ridurre il numero di risultati falsi positivi e falsi negativi.
Al di sotto di queste soglie, l'affidabilità del risultato ottenuto non è adeguata alle finalità per cui i test vengono eseguiti ”.
Il documento completo en materia di test según COVID-19 pubblicato da FNOMCEO e riferimento per i medici italiani
Copia_DocPrincipal_COVID_19__test_v4k_lastPrueba COVID-19, bibliografía
1. Organización Mundial de la Salud. Perfiles de productos de destino para diagnóstico prioritario
tics para apoyar la respuesta a la pandemia COVID-19 v.1.0. Ginebra: OMS; 2020
2. Mina MJ, Parker R, Larremore DB. Repensar la sensibilidad de la prueba Covid-19: una estrategia de contención. N Engl J Med 2020 30 de septiembre. DOI: 10.1056 / NEJMp2025631
3. Comisión Europea. Rendimiento actual de los métodos y dispositivos de prueba COVID-19 y criterios de rendimiento propuestos (16 de abril de 2020). Bruselas: CE; 2020. https://ec.europa.eu/docsroom/documents/40805.
4. Comisión Europea. Base de datos de métodos de prueba y dispositivos de diagnóstico in vitro COVID-19. Bruselas: CE; 2020. https://covid-19-diagnostics.jrc.ec.europa.eu/ ).
5. Ministero della salute. Pandemia di COVID-19 - Aggiornamento delle indicazioni sui test diagnostici e sui criterio da adottare nella determinazione delle priorà. Aggiornamento delle indicazioni relativas alla diagnosisi di laboratorio (0011715-03 / 04/2020). Roma: Ministero della Salute; 2020.
6. Mancini F, Barbanti F, Scaturro M, et al. Gestión de laboratorio para la detección del SARS-CoV-2: una combinación fácil de usar del enfoque de tratamiento térmico y la prueba de PCR en tiempo real rt. Emerg Microb Infect. 2020; 9 (1): 1393-1396. DOI: 10.1080 / 22221751.2020.1775500.
7. Fomsgaard AS, Rosenstierne MW. Un flujo de trabajo alternativo para la detección molecular del SARS CoV-2: escape de la escasez de kits de extracción de NA, Copenhague. Dinamarca. Euro Surveill. 2020; 25: 2000398. doi: 10.2807 / 1560-7917.ES.2020.25.14.2000398
8. Cheng MP, Papenburg J, Desjardins M, et al. Pruebas de diagnóstico para el Coronavirus-2 relacionado con el síndrome respiratorio agudo severo: una revisión narrativa [publicado en línea antes de la impresión, 2020 de abril de 13]. Ann Intern Med. 2020: M201301 10.7326 / M20-1301.
9. Centros para el Control y la Prevención de Enfermedades. Descripción general de las pruebas para SARS-CoV-2 (COVID-19). Atlanta, GA: CDC; 2020. https://www.cdc.gov/coronavirus/2019-ncov/hcp/testing-overview.html
10. Organización Mundial de la Salud. Detección de antígenos en el diagnóstico de infección por SARS-CoV-2 mediante inmunoensayos rápidos. Orientación provisional. Ginebra: OMS; 2020. https://www.who.int/publications/i/item/antigendetection-in-the-diagnosis-of-sars-cov-2infection-using-rapid-immunoassays
11. Dinnes J, Deeks JJ, Adriano A, Berhane S, Davenport C, Dittrich S, Emperador D, Takwoingi Y, Cunningham J, Beese S, Dretzke J, Ferrante di Ruffano L, Harris IM, Price MJ, Taylor-Phillips S , Hooft L, Leeflang MMG, Spijker R, Van den Bruel A. Pruebas rápidas basadas en antígenos y moleculares en el lugar de atención para el diagnóstico de la infección por SARS ‐ CoV ‐ 2. Base de datos Cochrane de revisiones sistemáticas 2020, número 8. Art. No .: CD013705. DOI: 10.1002 / 14651858.CD013705
12. Castro R, Luz PM, Wakimoto MD, Veloso VG, Grinsztejn B, Perazzo H. COVID-19: un metaanálisis de la precisión de las pruebas de diagnóstico de los ensayos comerciales registrados en Brasil [publicado en línea antes de la impresión, 2020 de abril de 18]. Braz J Infect Dis. 2020; S14138670 (20): 530029. DOI: 10.1016 / j.bjid.2020.04.003
13. Russo A, Minichini C, Starace M, et al. Estado actual del diagnóstico de laboratorio para COVID-19: una revisión narrativa. Infectar resistente a las drogas. 2020; 13: 2657-2665. doi: 10.2147 / IDR.S264020
14. Tubería de diagnóstico del SARS-CoV-2. https://www.finddx.org/covid-19/pipeline/ .
Para obtener más información:
El tampón salivar para niños inventados por 4 científicos (e mamme) de UniMi



