Testas pagal COVID-19, „Ministero della Salute“ indikacijos ir medicininės priemonės: ekologinė kokybė ir ešeriai
Testas pagal COVID-19, il Ministero della Salute ha diffuso il documento „Test di laboratorio per SARS-CoV-2 e loro uso in sanità pubblica“, contente indicazioni sui criteri di scelta dei test a disposizione, per un uso razionale e sostenibile delle risorse nei diversi contesti.
Tai dokumentas di riferimento per i medici italiani, ir vien difuzija Pdf da Fnomceo, la Federazione degli Ordini dei Medici ir degli Odontoiatri italiani.
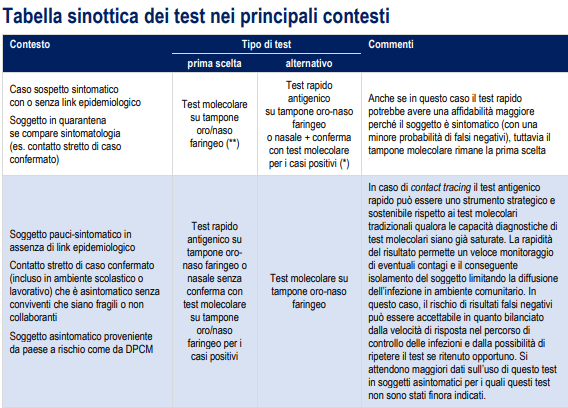
Perché nel mezzo della seconda ondata dell'epidemia di coronavirus, è essenziale la scelta dei test a disposizione nei diversi contesti per un uso razionale e sostenibile delle risorse.
Klausimas, patvirtinantis, kad informacija yra disponibili al momento della sua pubblicazione e può essere aggiornato se ulteriori evidenze scientifiche saranno disponibili.
Testas COVID-19, PSO nurodymai
Pasaulio sveikatos organizacijos (PSO) indikacijos, susijusios su dokumento sono linija, pateikiamos kartu su indikatoriais, nurodant COPID-19 profilio tikslą COVID-19, pagal kurį pateikiami dokumentai „Tiksliniai produktų profiliai prioritetinei diagnostikai, siekiant paremti atsaką į COVID1.0 pandemijos v.28 “del 2020 setembre 2 che descrivono le caratteristiche principali dei test per SARS-CoV-XNUMX, ma che sottolineano anche la välttità che essi soddisfino non solo i criteri di specificità e sensibilità, ma anche caratteristiche di test rapido che ne favorisca l'uso in determinati contesti.
Europos ligų prevencijos ir kontrolės centras (ECDC), atlikdamas 5 bandymus, patikrina: kontroliuoja lašišą;
monitorare l'incidenza, l'andamento e valutare la gravità nel tempo;
mitigare l'impatto del COVID-19 nelle strutture sanitarie e socioassistenziali;
rilevare klasteris arba focolai in contesti specifici;
prevenire la (re) introduzione nelle aree che hanno raggiunto un controlo sostenuto del virus.
Aš išbandau „COVID-19 attualmente disponibili per scopi di sanità pubblica“
Įvertinkite ir išbandykite tris pagrindines grupes: tampono molekulės, tampono antigeniko rapido, sierologinio testo.
COVID-19, išbandysiu molekulinį medianto tamponą
Si tratta di una molekulinės atvirkštinės transkripcijos (rt) -Real Time PCR per la rilevazione del genoma (RNR) del viruso SARS-CoV-2 ir biologinio kampiono.
Questa metodica permette di identare in modo altamente specifico e sensibile uno o più geni bersaglio del virus virus presenti nel campione biologico e di misurare in temporo reale la concentrazione iniziale della sequenza target.
Aš reaguoju metu tikrojo laiko PGR, seppur con indicazioni quality così come descritti e suggeriti dagli organi internazionali di riferimento, permettono di ottenere una curva di amplificazione il cui Cycle Threshold o ciclo soglia (CT) inversamente proporzionale alla quantità del stampo iniziale presente nel campione.
Quindi, iš esmės Questo Princio, Maggiore è il numero delle “molecole stampo” presenti all'inizio della reazione e minore sarà il numero di cicli necessari per raggiungere un determinato valore di CT.
Viceversa, un alto valore di CT, ottenuto dopo numerosi cicli di amplificazione, indica anda bassa quantità di target genico iniziale e quindi di genoma virale. „La rt-Real Time PCR“ yra „auksinis standartas“ pagal COVID-19 diagnozę.
La Rilevazione dell'RNA virale di SARS-CoV-2 eseguita in laboratorio da campioni clinici (in genere tamponi nasofaringei o orofaringei) ad oggi rimane il saggio di riferimento internazionale per sensibilità e specificità ed è in grado di rilevare il carogenicache virale in soggetti sintomatici, pre-sintomatici o asintomatici.
Per la complessità della metodica, la rilevazione di SARS-CoV-2 vien eseguita esclusivamente in laboratori special con con operatori esperti (5).
Il risultato può esser ottenuto in unimo per 3-5 ore ma situazioni organizacative e logistiche possono richiedere anche 1-2 giorni.
È būtinasis ricordare che ai fini della segnalazione dei casi nel sistema della sorveglianza integrata COVID-19, coordinata da ISS, vengono considerati solo i risultati positivi ottenuti tramite rt-Real Time PCR dai laboratori di riferimento regionali o dai laboratori identifier / autorizzati da questi ( https://www.epicentro.iss.it/coronavirus/sars-cov-2- sorveglianza).
Si aggiunge la possibilità di effettuare l'analisi dei test molekularari senza effettuare l'estrazione and la purificazione dell'RNA dal campione biologico, ma di utilizzare la tecnica della inattivazione al calore (95 ° C / 98 ° C) („a crudo“). ).
Ciò permette di semplificare, massimizzare and velocizzare il primo step dell'analisi stessa, special fore condicioni di forte pressione sui laboratori dovuti all'aumentare dei tamponi da processare.
„Il rischio di perdita di sensibilità può considerarsi minimo e presente solo ad alti numeri di cicli di amplificazione della PCR, come riportato da lavori scientifici internazionali“ (6–7).
Tuttavia, la senssibilità risulta essere superiore al test antigenico.
Testas antigenico rapido (mediante tampone nasale, naso-oro-faringeo, salivare) kiekvienam Covid-19
Negli ultimi mesi, sono stati sviluppati nuovi tipi di test che promettono di offrire risultati più rapidamente (30-60 minuti), con minor costo e senza la välttità di personalale specialzato (8).
Patikrinkite antigenici rapidi, strumenti potenzialmente utili soprattut per indagini di screening.
Analogamente ai testavimo molekulės, i saggi antigenici sono di tipo diretto, ossia valutano direttamente la presenza del virus nel campione clinico, a differentenza dei test sierologici che sono di type indiretto, cioè rilevano la Presenza di anticorpi specifici che indicano una inezione pregressa o .
Diferenza dei testo molekulolari, però, i testu antigenici rilevano la presenza del virus non tramite il suo acido nucleico ma tramite le sue proteine (antigeni).
Questi test contengono come substrato anticorpi specifici in grado di legarsi agli antigeni virali di SARS-CoV-2 ed il risultato della reazione antigene-anticorpo può essere direttamente visibile a occhio nudo o letto mediante una semplice apparecchiatura al “point of care” sen di essere effettuato in un laboratorio.
Neįmanoma nustatyti 3 bandymų antigenų, susijusių su FDA autorių teisių statusu. „Europa“ numerosi test hanno già ottenuto il marchio CE Įvairi diagnostikos stanno lavorando per tenenere l'approvazione normativa idonea per essere immessi sul mercato con un enoughe grado di affidabilità (9).
Aš išbandau antigenici sono di tipo qualityitivo (sì / no) e intercettano, tramite anticorpi policlonali o monoclonali, specifici peptidi (porzioni proteiche) della proteina S (Spike) o N (nucleocapside) presenti sulla superficie virale di SARS-CoV-2.
Il test può risultare negativo se la concentrazione degli antigeni è inferiore al limite di rilevamento del test (es. Se il prelievo è stato eseguito troppo precocemente rispetto all'ipotetico momento di esposizione) o se il campione è stato prelevato, trasportia o.
Už tai, kad aš gaminsiu tali rinkinį evidenziano che ir risultato negativo del test non esclude la possibilità di un'infezione da SARS-CoV-2 e la negatività del campione, forte di forte sospetto di COVID-19, dovrebbe essere confermata mediante test molekulinė.
Aš išbandau molekulinį sembrano avere una maggiore sensibilità prima della Comparesa dei sintomi, mentre nella fase iniziale instantamente successiva all'inizio dell'infezione i testą rapidi antigenici e quelli molecolari hanno una sensibilità simile, rendendo utile l'uso anche dei primi (
Inoltre, il test rapido antigenico può essere utilizzato per l'identificazione dei contatti asintomatici dei casi, anche se questo type di test non è specificamente autorizzato per questa destinazione d'uso, poiché è stato dimostrato che i casi asintomatici hanno cariche virali simili ai sintomatinis (10).
„Purtroppo“, „fino ad oggi non vi sono enoughi studi pubblicati che“, „a contonte di contesti specifici and di una ampia casistica“, „forniscano indicazioni sulla sensibilità“ ir „specificità di questi test Rapidi“.
Allo stato attuale, i data dispponibili dei vari test for questi parametri sono quelli dichiarati dal produttore: 70-86% per sensibilità and 95-97% for specific specific (11-14)
„La Foundation for Innovative New Diagnostics“ (FIND) (https://www.finddx.org/covid19/pipeline/?section=show-all#diag_tab) sukurta ir nepakeista forma internete, naudojant „Rapida Evolution“, „Raccoglie“ ir „SARG“ serijas. - „CoV-2 che vanno“, kuris yra pagrindinis „sviluppo fino“, visų pieno patvirtinimo normatyvas.
Riguardo i testas su tamponiniu seiliu, dislokacija rilevazione è lo stesso, ma cambiando il campione analizzato possono cambiare le caratteristiche di sensibilità and specificit del test.
Apibendrinant, la sensibilità e la specificità di questi test antigenici rapidi dovranno essere valutate per i loro valori predittivi nel corso del loro sviluppo tecnologico.
È importante la condivisione dei dati a livello locale / regionale / nazionale delle validazioni su vari tipi di test antigenici rapidi, inclusi quelli salivari, in komercio nel nostro paese.
Testas sierologici
Aš bandau sierologici rilevano l'esposizione al virus SARS-COV- 2 ma non sono in grado di confermare o meno una infezione in atto.
Už tai, kas reikalinga ir reikia išbandyti tampono molekulę per konferenciją.
Come da circolare del Ministero della Salute 16106 del 9 maggio 2020, si ribadisce che “la qualityità e l'affidabilità di un test dipendono in particolare dalle due caratteristiche di specificità e sensibilità, e pertanto, sebbene non sussistano in relazione ad esse obblighi di legge , è fortemente raccomandato l'utilizzo di test del tipo CLIA e / o ELISA che abbiano una specificità non inferiore al 95% e una sensibilità non inferiore al 90%, al fine di ridurre il numero di risultati falsi positivi e falsi negativi.
Al di sotto di queste soglie, l'affidabilità del risultato ottenuto non è adeguata all finalità per cui i test vengono eseguiti “.
Suderintas testo dokumentas, skirtas COVID-19 FNOMCEO ir riferimento vaistams ir medicinai
„Copia_DocPrincipale_COVID_19__test_v4k_last“Testas COVID-19, bibliografija
1. Pasaulio sveikatos organizacija. Tiksliniai produktų profiliai pagal prioritetines diagnozes
remti atsaką į v19 pandemiją. Ženeva: PSO; 1.0 m
2. Mina MJ, Parker R, Larremore DB. Persvarstyti Covid-19 testo jautrumą - izoliavimo strategija. N Engl J Med 2020 rugsėjo 30 d. DOI: 10.1056 / NEJMp2025631
3. Europos Komisija. Dabartinis COVID-19 bandymo metodų ir prietaisų veikimas ir siūlomi našumo kriterijai (16 m. Balandžio 2020 d.). Briuselis: EB; 2020 m. https://ec.europa.eu/docsroom/documents/40805.
4. Europos Komisija. COVID-19 in vitro diagnostikos prietaisų ir tyrimo metodų duomenų bazė. Briuselis: EB; 2020 m. https://covid-19-diagnostics.jrc.ec.europa.eu/ ).
5. Ministero della salute. Pandemia di COVID-19 - Aggiornamento delle indicazioni sui test diagnostici e sui criteri da adottare nella determinazione delle priorà. Aggiornamento delle indicazioni giminaitis alla diagnosi di laboratorio (0011715-03 / 04/2020). Roma: Ministero della Salute; 2020 m.
6. Mancini F, Barbanti F, Scaturro M ir kt. Laboratorinis valdymas nustatant SARS-CoV-2: patogus terminio apdorojimo metodo ir realaus laiko PGR testavimo derinys. Avarinis mikrobų užkratas. 2020; 9 (1): 1393–1396. DOI: 10.1080 / 22221751.2020.1775500.
7. „Fomsgaard AS“, Rosenstierne MW. Alternatyvi SARS CoV-2 molekulinio aptikimo darbo eiga - pabėgimas iš NA ištraukimo rinkinio trūkumo, Kopenhaga. Danija. „Euro Surveill“. 2020; 25: 2000398. doi: 10.2807 / 1560- 7917.ES.2020.25.14.2000398
8. Cheng MP, Papenburg J, Desjardins M ir kt. Diagnostiniai sunkaus ūminio kvėpavimo sindromo, susijusio su koronavirusu-2, tyrimai: pasakojimo apžvalga [paskelbta internete prieš spausdinimą, 2020 m. Balandžio 13 d.]. Ann Intern Med. 2020 m .: M201301 10.7326 / M20-1301.
9. Ligų kontrolės ir prevencijos centrai. SARS-CoV-2 (COVID-19) testavimo apžvalga. Atlanta, GA: CDC; 2020 m. https://www.cdc.gov/coronavirus/2019-ncov/hcp/testing-overview.html
10. Pasaulio sveikatos organizacija. Antigeno aptikimas diagnozuojant SARS-CoV-2 infekciją naudojant greitus imuninius tyrimus. Laikinos rekomendacijos. Ženeva: PSO; 2020 m. https://www.who.int/publications/i/item/antigendetection-in-the-diagnosis-of-sars-cov-2infection-using-rapid-immunoassays
11. Dinnes J, Deeks JJ, Adriano A, Berhane S, Davenport C, Dittrich S, Emperador D, Takwoingi Y, Cunningham J, Beese S, Dretzke J, Ferrante di Ruffano L, Harris IM, Price MJ, Taylor-Phillips S , Hooft L, Leeflang MMG, Spijker R, Van den Bruel A. Rapid, antigeno priežiūros ir molekuliniai tyrimai SARS ‐ CoV ‐ 2 infekcijos diagnozavimui. „Cochrane“ sisteminių apžvalgų duomenų bazė, 2020 m., 8 leidimas. Nr .: CD013705. DOI: 10.1002 / 14651858.CD013705
12. Castro R, Luz PM, Wakimoto MD, Veloso VG, Grinsztejn B, Perazzo H. COVID-19: Brazilijoje registruotų komercinių tyrimų diagnostinių tyrimų tikslumo metaanalizė [paskelbta internete prieš spausdinimą, 2020 m. Balandžio 18 d.]. Braz J Infect Dis. 2020; S14138670 (20): 530029. DOI: 10.1016 / j.bjid.2020.04.003
13. Russo A, Minichini C, Starace M ir kt. Dabartinė COVID-19 laboratorinės diagnostikos būklė: pasakojimo apžvalga. Užkrėskite vaistų atsparumą. 2020; 13: 2657-2665. doi: 10.2147 / IDR.S264020
14. SARS-CoV-2 diagnostinis vamzdynas. https://www.finddx.org/covid-19/pipeline/ .
Gilinti:
„Covid-19“ bandymas: įvairios tipologijos padengimas, kosminis atstatymas ir molekulinė sudėtis
Tamponinis seilių rinkinys, skirtas „UniMi 4“ moksliniams tyrimams (e)



