Przeszczepianie narządów: z czego się składa, jakie są etapy i co przyniesie przyszłość
Przeszczepianie narządów to zabieg chirurgiczny, w ramach którego jeden lub więcej chorych narządów (których funkcji nie można już odzyskać) zastępuje się jednym lub kilkoma narządami pobranymi od dawcy (zwłok lub żywego).
Operacja, która koncepcyjnie ma swoje korzenie w najwcześniejszej historii ludzkości (po raz pierwszy mówili o niej chińscy lekarze), jest jednak bardzo niedawnym rozwiązaniem terapeutycznym: wiedza, która to umożliwiła (immunologia, badanie antygenów…) była nabyte dopiero na początku XX wieku.
Od 1950 r. transplantacja stała się ustalonym wyborem w leczeniu tych patologii, które prowadzą do nieodwracalnego zniszczenia narządu, a tym samym do śmierci pacjenta.
Ale transplantacja to nie tylko ostatnia perspektywa dla tych, których życie jest zagrożone: operacja ta umożliwia również poprawę jakości życia pacjentów cierpiących na przewlekłe choroby powodujące niepełnosprawność (np. przeszczep nerki u pacjentów dializowanych).
Przyszłość transplantacji nie została jeszcze naszkicowana, ale w umysłach naukowców i lekarzy zajmujących się badaniami jest bardzo jasna: wszczepianie sztucznych narządów lub narządów pobranych od zwierząt genetycznie zmodyfikowanych (ksenotransplantacja), klonowanie i wszczepianie komórek macierzystych to tylko niektóre kierunków, w jakich porusza się światowy krajobraz naukowy.
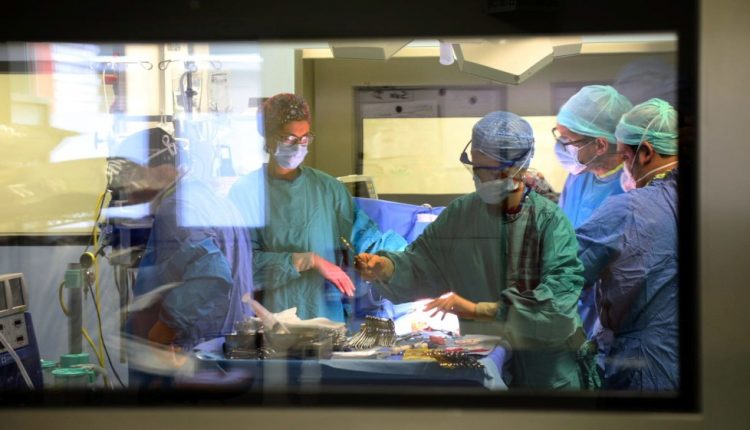
Chirurgia transplantacji narządów
Słowo „przeszczep” często w sposób redukcyjny wskazuje na operację wymiany chorego narządu na zdrowy.
W rzeczywistości za tą operacją kryje się cała organizacja i przygotowanie, które wymaga niezwykłej precyzji i synchronizacji ludzi i instrumentów.
Praktyka operacji różni się w zależności od dawcy: jeśli pobranie narządu pochodzi od żywej osoby, w rzeczywistości możliwe jest zaplanowanie operacji; co jest oczywiście niewykonalne, jeśli narządy pochodzą od dawcy nieżyjącego, który zmarł z przypadkowych i nieprzewidywalnych przyczyn.
Po uzyskaniu przez komisję lekarską zgody rodziny i stwierdzeniu, że nastąpiła śmierć mózgu potencjalnego dawcy, rozpoczyna się ocena jego danych: zgodność z potencjalnymi biorcami na listach oczekujących, historia choroby, cechy immunologiczne, grupa krwi itp.
Przeszczepianie narządów przebiega w kilku etapach
FAZA 1
Osoba z urazami, które mogą być dawcą (na przykład bardzo poważnym urazem głowy) zostaje przyjęta na oddział intensywnej terapii.
Lekarz rozmawia z rodziną o możliwości oddania swoich narządów; jeśli są dostępne, natychmiast powiadamiane jest centrum koordynacyjne, które odpowiada za zgłoszenie potencjalnego darczyńcy i zidentyfikowanie potencjalnego biorcy.
Tymczasem oceniane są dane pacjenta dawcy: zgodność z potencjalnymi biorcami na liście, historia choroby, cechy immunologiczne. Rozpoczyna się 6-godzinny okres obserwacji, który jest obowiązkowy przed poświadczeniem śmierci mózgu.
FAZA 2
Zespół eksplantacyjny jest aktywowany i musi być dostępny w bardzo krótkim czasie.
Lekarze zazwyczaj docierają do placówki helikopterem. Tymczasem w szpitalu, w którym będzie wykonywany przeszczep, biorca jest wzywany na różne badania i ocenę stanu zdrowia.
Przeprowadzane są również liczne kontrole narządów, które mają zostać oddane, aby zapobiec przenoszeniu chorób zakaźnych lub nowotworów z dawcy na biorcę.
FAZA 3
Pod koniec okresu obserwacji, jeśli wszystkie wskazania wskazują na diagnozę nieodwracalnej śmierci mózgu, można rozpocząć eksplantację (około 2 godziny).
Odbiorca wchodzi na salę operacyjną i jest przygotowany do operacji. Rozpoczyna się podawanie leków immunosupresyjnych, aby uniemożliwić limfocytom rozpoznanie narządu jako obcego i spowodowanie odrzucenia.
FAZA 4
Narząd w końcu przybywa, zanurzony w specjalnym roztworze chroniącym komórki i transportowany w specjalnym pojemniku wypełnionym lodem, aby spowolnić jego aktywność komórkową.
Jeden zespół lekarzy przygotowuje biorcę, drugi zajmuje się czyszczeniem narządu do przeszczepu.
FAZA 5
Teraz można rozpocząć przeszczep: naczynia krwionośne są połączone, krwawienie jest opanowane.
KROK 6
Pacjent wychodzi z sali operacyjnej, ale nadal znajduje się w znieczuleniu, które zostanie przedłużone co najmniej o kolejne 6-8 godzin, aby nowy narząd mógł przyzwyczaić się do różnicy temperatur między pojemnikiem z lodem a ciałem oraz, oczywiście do samego organu.
Pacjent pozostaje podłączony do urządzenia, aby oddychać.
KROK 7
Pacjent budzi się na oddziale intensywnej terapii; jeśli jego stan ogólny jest dobry, zdejmuje się go ze sztucznego respiratora.
Po około 4 dniach znowu zaczyna chodzić i jeść.
Po około 10 dniach będzie mógł opuścić szpital i zamieszkać z nowym organem.
Początkowo będzie musiał codziennie wracać do szpitala na badania immunologiczne; po roku będzie mógł wracać raz na dwa miesiące.
Usuwanie narządów
Po ustaleniu śmierci mózgu i uzyskaniu zgody rodziny (w przypadku braku wyraźnych życzeń dawcy), potencjalny dawca nie jest już wspomagany przez respirator mechaniczny, a narządy mogą być pobierane do przeszczepu w tym samym szpitalu, w którym został on uznany za odpowiedni. .
Wcześniej zaalarmowany zespół wchodzi na salę operacyjną w celu przeprowadzenia operacji usunięcia.
Sprzeciw wobec usunięcia nigdy nie oznacza pomocy pacjentowi w zapewnieniu lepszej opieki; w rzeczywistości opieka kończy się w momencie ustalenia śmierci mózgu; sprzeciwienie się temu oznaczałoby zatem jedynie pozbawienie kogoś lepszego życia dzięki nowemu organowi.
Dziś zyskuje również inny rodzaj przeszczepu, od żywych ludzi.
Rzeczywiście, obecnie możliwe jest pobranie płata nerki, wątroby lub płuca do przeszczepu u osób szczególnie zagrożonych, które nie przetrwałyby na liście oczekujących.
Są to zazwyczaj dzieci, zarówno z powodu niedoboru pediatrycznych narządów do przeszczepu, jak i niewielkich rozmiarów, co również oznacza, że dawca nie jest narażony na zbyt duże ryzyko.
Pobrane narządy wymagają specjalnych zabiegów, aby zachować je do przeszczepu.
Dla każdego narządu istnieje maksymalny czas przechowywania, po przekroczeniu którego tkanki, które nie otrzymują już krwi, a tym samym tlenu, ulegają martwicy, tzn. ich komórki obumierają i nie nadają się do użytku.
Czasy te różnią się w zależności od narządu: serce (4-6 godzin), płuco (4-6 godzin), wątroba (12-18 godzin), nerka 48-72 godziny, trzustka (12-24 godziny).
Przeszczepianie narządów: odrzucenie
Odrzucenie to reakcja organizmu biorcy na przeszczepiony narząd lub tkankę.
W rzeczywistości układ odpornościowy biorcy rozpoznaje narząd jako obcy i atakuje go tak, jakby był patogenem.
Istnieją cztery rodzaje odrzucenia
- odrzucenie nadostre: jest to najszybsze i występuje w ciągu kilku minut lub godzin po przeszczepie;
- przyspieszone odrzucenie: często występuje u pacjentów, którzy otrzymali już wcześniej przeszczep i występuje 3-4 dni po operacji;
- ostre odrzucenie: występuje po okresie od 5 do 90 dni; specyficznymi objawami są obrzęk, gorączka i utrata funkcji przeszczepionego narządu;
- przewlekłe odrzucenie: rozwija się około 3 miesięcy po przeszczepie i może spowodować uszkodzenie tkanki nowego narządu aż do utraty funkcji.
Doświadczenie odrzucenia przeszczepionego narządu niekoniecznie oznacza nieuchronną jego utratę; wręcz przeciwnie, odrzucenie jest skutecznie leczone, jeśli działania zostaną podjęte w rozsądnym czasie poprzez zastosowanie leków immunosupresyjnych.
Leki immunosupresyjne, które lekarz przepisze po przeszczepie, pomogą przeszczepionemu narządowi nie ryzykować odrzucenia i zachować zdrowie.
Ponieważ komórki układu odpornościowego są różne, leki przepisywane na immunosupresję również będą inne.
Wskazania i przeciwwskazania do przeszczepu narządów
Największym i najpilniejszym wskazaniem do przeszczepu jest nieodwracalna niewydolność ważnych narządów, takich jak nerki, wątroba, płuca, trzustka, ale także rogówki, szpik kostny, jelita.
Rzeczywiście, w takich przypadkach przeszczep jest jedynym skutecznym sposobem leczenia zapewniającym przeżycie.
Dlatego każdy stan patologiczny uniemożliwiający funkcjonowanie narządu w sposób zagrażający przeżyciu pacjenta należy uznać za wskazanie do przeszczepu.
Opieka pooperacyjna
Po przeszczepie biorcy są przyjmowani przez pierwsze dni na oddział intensywnej terapii, gdzie rozpoczyna się leczenie immunosupresyjne.
Pacjent z obniżoną odpornością wymaga izolacji w „sterylnych” pomieszczeniach, specjalnie stworzonych w celu uniknięcia wszelkiego rodzaju zanieczyszczenia ze środowiska zewnętrznego.
„Pudełko”, w którym przyjmowany jest biorca po operacji przeszczepu, jest całkowicie odizolowane od reszty jednostki resuscytacyjnej stosowanej do konwencjonalnej chirurgii.
Stan ścisłej izolacji utrzymuje się tak długo, jak długo trwa pokonanie przez pacjenta krytycznej fazy pooperacyjnej (zwykle 5-6 dni) lub w przypadkach, gdy wymagana jest terapia zapobiegająca odrzuceniu.
Wizyty u pacjentów po przeszczepie
W bezpośrednim okresie pooperacyjnym wizyty u bliskich krewnych są dozwolone, o ile są odpowiednio ubrani (zgodnie z procedurami wejścia do pomieszczeń czystych).
Każda osoba jest wpuszczana do strefy filtracyjnej pojedynczo i oczywiście osoby z podejrzeniem i/lub dowodami na choroby zakaźne nie mogą być wpuszczone.
Przyszły rozwój
Najpoważniejsze problemy w medycynie transplantacyjnej to z jednej strony odrzucenie przeszczepionego narządu, az drugiej niewydolność oddawanych narządów w stosunku do potrzebnych.
W obu kierunkach badania eksperymentują z różnymi rozwiązaniami w celu przezwyciężenia tych problemów.
W odniesieniu do odrzucenia podejmowane są próby stworzenia rozwiązań, które potrafią oszukać układ immunologiczny, ograniczając w ten sposób obecnie stosowaną terapię immunosupresyjną, lub które chronią przeszczepiony narząd przed atakiem limfocytów T, które są odpowiedzialne za eliminację czynników poza organizmem .
Z drugiej strony eksperymentuje się z niedoborem organów, sztucznymi narządami, inżynierią tkankową czy ksenotransplantacją, które mogą zastąpić narządy ludzkie.
Terapia genowa
Dzięki terapii genowej możliwe jest dotarcie do źródła problemu i wyeliminowanie defektów genetycznych bezpośrednio w zaatakowanych komórkach, tkankach lub narządach.
Zdrowy gen wprowadzany jest bezpośrednio do miejsca dotkniętego chorobą, gdzie zaczyna wytwarzać substancje, których chory organizm nie jest w stanie sam wytworzyć.
Jednak terapia genowa jest wciąż daleka od stosowania. Aby móc przetransportować obce DNA do jądra komórkowego, potrzebne są specjalne „wektory” – wirusy, które utraciły swoje cechy zakaźne, ale nadal są w stanie atakować komórki i przekazywać im swoje dziedzictwo genetyczne.
Aby uniknąć odrzucenia, przeszczepiony narząd musiałby być leczony w laboratorium, przenosząc do niego geny, które umożliwiłyby mu obronę przed układem odpornościowym biorcy.
Teraz geny są znane, ale nie są jeszcze traktowane z niezbędną precyzją. Kolejnym krokiem będzie poszukiwanie idealnej kombinacji genów, która uniemożliwia działanie wszystkich mechanizmów immunologicznych biorcy.
Inżynieria tkankowa
Celem tego typu terapii jest znalezienie alternatywy dla narządów ludzkich.
Już teraz naukowcy są w stanie wytwarzać w laboratorium tkanki, takie jak naczynia krwionośne, zastawki serca, chrząstki i skóra.
Możliwe było pokonanie tej nowej granicy dzięki temu, że komórki mają tendencję do agregacji, tworząc organy i tkanki.
Komórki macierzyste
Komórki macierzyste to niezróżnicowane komórki znajdujące się w ludzkich embrionach tydzień po zapłodnieniu.
Są również komórkami „startowymi”, z których wykształcą się tkanki i narządy dziecka, które ma się narodzić.
Ich funkcją jest regulacja obrotu krwinek (czerwonych krwinek, białe krwinki i płytek krwi) oraz układu odpornościowego (limfocyty).
Obecnie do zbierania tych komórek stosuje się skomputeryzowane maszyny, separatory, pozwalające na wybór potrzebnych komórek. Odbiorcami komórek są pacjenci cierpiący na choroby skóry, choroby krwi lub guzy lite.
Oprócz tego, że komórki macierzyste są nadal w dużej mierze nieznane, istnieje również problem etyczny: zbieranie embrionalnych komórek macierzystych oznacza śmierć embrionu.
Dlatego udoskonala się sposób pozyskiwania komórek macierzystych od dorosłych.
Klonowanie
Technika klonowania pozwoliłaby całkowicie ominąć problem odrzucania narządów.
Polegałoby to na wprowadzeniu jądra komórkowego pacjenta, wraz z całym jego genetycznym dziedzictwem, do komórki macierzystej ludzkiego embrionu lub oocytu, który wcześniej nie miał własnego jądra.
Hodowane in vitro w laboratorium te zmodyfikowane komórki byłyby genetycznie identyczne z komórkami układu odpornościowego pacjenta, który nie rozpoznałby ich jako obcych.
Technika ta nie jest obecnie realną opcją, ponieważ zarówno klonowanie, zbieranie komórek macierzystych, jak i masowe wykorzystywanie oocytów są prawnie zabronione.
Ksenotransplantacja
Ksenotransplantacja, czyli przeszczepianie komórek zwierzęcych, tkanek i narządów ludziom, wydaje się być przyszłym rozwiązaniem niedoboru narządów do przeszczepów.
Eksperymenty w tej dziedzinie są liczne i napotykają na problemy etyczne, psychologiczne i, co nie mniej ważne, immunologiczne.
W rzeczywistości kilka podjętych prób (przeszczepienie świńskiej wątroby i serca pawiana dwóm różnym istotom ludzkim) nie przyniosło pożądanych rezultatów.
W rzeczywistości kryzys odrzucenia był szczególnie gwałtowny i niemożliwy do kontrolowania.
Jednak ta technika może naprawdę być rozwiązaniem niedoboru narządów.
W rzeczywistości najbardziej obawia się rozwoju typowo zwierzęcych infekcji przenoszonych na ludzi przez patogeny obecne w przeszczepianym narządzie, co może okazać się katastrofalne.
Możliwą alternatywą dla tego upośledzenia mogą być modyfikacje genetyczne zwierząt dawców; w praktyce zwierzęta byłyby hodowane w sterylnym środowisku i modyfikowane genetycznie, aby ich narządy były bardziej kompatybilne z organizmem biorcy.
Na razie jednak osiągnięto kilka kamieni milowych; są to ksenoprzeszczepy komórek, a nie ksenoprzeszczepy narządów, takie jak komórki zarodków świni do leczenia choroby Parkinsona, komórki szpiku pawiana przeszczepiane nieuleczalnie chorym pacjentom z AIDS w celu odzyskania układu odpornościowego pacjentów lub wyspy trzustki nadal od świń w stymulacji produkcji insuliny jako terapii przeciw cukrzycy.
Przeszczepianie narządów: sztuczne narządy
Innym rozwiązaniem niewydolności narządów, takiej jak odrzucenie, są sztuczne narządy.
Głównym problemem jest zgodność biologiczna; są to przecież narządy mechaniczne, które muszą przystosować się do organizmu biologicznego.
Biokompatybilność musi obejmować wszystkie cechy morfologiczne, fizyczne, chemiczne i funkcjonalne, które są w stanie zapewnić funkcjonalność narządu, a jednocześnie jego przetrwanie bez ryzyka odrzucenia.
To wszystkie te implikacje sprawiają, że produkcja sztucznych narządów jest w stanie całkowicie i perfekcyjnie zastąpić „naturalne” narządy w ich funkcjach złożonych.
Czytaj także:
Emergency Live jeszcze bardziej…Live: Pobierz nową darmową aplikację swojej gazety na iOS i Androida
Transplantacja narządów: diagnostyka i opieka nad oczekującymi pacjentami
Co to jest transplantacja serca? Przegląd
Jak wykonuje się przeszczep twarzy? – WIDEO



