Bakterioterapia kału: transplantacja kału w przypadku Clostridium difficile, zapalenia jelita grubego i choroby Leśniowskiego-Crohna
Bakterioterapia kału, znana również jako transplantacja kału lub transfuzja kału lub infuzja ludzkich probiotyków (HPI) lub przeszczep mikrobiomu kału, jest niefarmakologicznym leczeniem medycznym, w fazie eksperymentalnej, stosowanym z pewną skutecznością u pacjentów cierpiących na rzekomobłoniaste zapalenie jelita grubego wywołane przez Clostridium difficile bakteria (ostatnio przemianowana na „Clostridium difficile”); lub nawet w przypadkach wrzodziejącego zapalenia jelita grubego opornego na powszechnie stosowane terapie
Celem tej innowacyjnej terapii jest przywrócenie ekologii drobnoustrojów i homeostazy okrężnicy poprzez ponowne wprowadzenie zdrowej (zrównoważonej) mikrobioty ludzkiej, pobranej z kału zdrowego dawcy lub w niektórych przypadkach z kału wcześniej „oddanego” przez tego samego pacjenta ( homotransfuzji lub autologicznej odbudowie flory przewodu pokarmowego – ARGF).
Teoretycznego uzasadnienia dla tej techniki terapeutycznej należy szukać w najbardziej zaawansowanych badaniach nad zastosowaniem probiotyków oraz badaniach nad mikrobiomem, czyli zespołem mikroorganizmów: bakterii, archeobakterii, grzybów, wirusów, obecnych w określonym środowisku (w tym w przypadku środowiska kałowego).
Powszechnie wiadomo, w jaki sposób dobra ekologia mikrobiologiczna może powstrzymać nadmierny wzrost organizmów chorobotwórczych.
Szacuje się, że w okrężnicy występuje od 500 do około 1000 różnych gatunków bakterii, w sumie 1013 bakterii.
W rzeczywistości mikrobiom powinien być traktowany jako samodzielna jednostka biologiczna, która jest w symbiozie z organizmem gospodarza.
Kompleks bakteryjny lub mikrobiom działa w utrzymaniu homeostazy organizmu gospodarza; ta flora bakteryjna jest stosunkowo nieszkodliwa po ponownym wprowadzeniu do organizmu.
Niewiele wiadomo na temat roli mikrobiomu, jednak wiadomo, że wiele roślinożernych i nieroślinożernych gatunków zwierząt ma nawyki koprofagiczne, prawdopodobnie z powodu podwójnego cyklu trawienia (podwójne trawienie).
Transplantacja kału: główną zaletą bakterioterapii kału jest zmniejszenie ryzyka wywołania oporności na antybiotyki u wysoce zjadliwych bakterii
Inne zalety to relatywnie niski koszt, brak konieczności stosowania leków i dobra skuteczność (co jednak trzeba potwierdzić większymi badaniami) w leczeniu przypadków oporności na antybiotyki.
Jednak metoda ta jest nadal uważana za leczenie „ostatniej szansy” ze względu na większą inwazyjność w porównaniu z konwencjonalnym leczeniem antybiotykami oraz potencjalne ryzyko przeniesienia infekcji (bakterie, wirusy, priony, pasożyty jelitowe).
Chociaż doświadczenie z bakterioterapią kału jest nadal ograniczone, opublikowane wyniki dotyczące tej procedury pokazują, że ponad 80 pacjentów wykazało średni wskaźnik sukcesu wynoszący ponad 90%
Bakterioterapia kału jest mało zaawansowaną technologicznie, łatwą do wykonania procedurą, która może przerwać cykle wielokrotnego stosowania antybiotyków, co z kolei zmniejsza ryzyko narastającej ostatnio oporności na antybiotyki.
Może również potencjalnie obniżyć koszty w porównaniu z wielokrotnym podawaniem antybiotyków i koniecznością hospitalizacji.
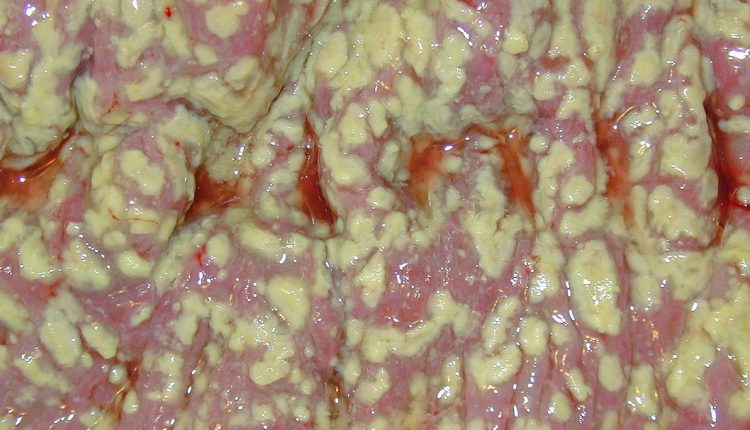
Rzekomobłoniaste zapalenie jelita grubego
Znaczenie tej techniki jako patogenu Clostridium difficile (CDI) zostało ugruntowane od 1978 r., ale znaczenie tej techniki w leczeniu rzekomobłoniastego zapalenia jelita grubego wynika również z faktu, że ostatnio zmieniła się jej epidemiologia, co stwarza poważne problemy diagnostyczne i terapeutyczne dla klinicystów .
Wskaźniki infekcji (CDI) podwoiły się z 31/100,000 1996 w 61 roku do 100,000/2003 XNUMX w XNUMX roku.
W ostatnich latach nasilenie i śmiertelność infekcji C. difficile CDI wzrasta, co przypisuje się nowemu zjadliwemu szczepowi C. difficile, znanemu jako szczep North American Pulsed-field Gel Electrophoresis typu 1 (NAP-1) lub również PFGE typ BI/NAP1 rybotyp 027.
Wyjątkowość szczepu NAP-1 polega na zwiększonej produkcji toksyn A i B oraz produkcji toksyn binarnych i odporności na fluorochinolony.
Hiperwirulentne szczepy C. difficile NAP1 są odpowiedzialne za większość niedawnych ognisk szpitalnych, a powszechne stosowanie antybiotyków fluorochinolonowych mogło ułatwić selektywną proliferację tego szczepu.
Szczep NAP1 jest również bardziej prawdopodobny do powodowania ciężkiego, piorunującego zapalenia jelita grubego charakteryzującego się wyraźną leukocytozą, ostrą niewydolnością nerek, niestabilnością hemodynamiczną i toksycznym rozszerzeniem okrężnicy.
C. difficile stała się najczęstszą bakteryjną przyczyną biegunki szpitalnej.
Zakażenie Clostridium difficile powoduje CDAD (chorobę związaną z Clostridium difficile) lub rzadziej rzekomobłoniaste zapalenie jelita grubego, które jest poważnym schorzeniem powodującym znaczną chorobowość i śmiertelność, zwłaszcza u pacjentów poddawanych leczeniu antybiotykami lub pacjentów z rakiem poddawanych przeszczepowi komórek macierzystych, a nawet u pacjentów poddawanych radioterapii .
Zwiększona częstość zakażeń hiperwirulentnymi szczepami C. difficile doprowadziła do powikłań i niepowodzeń terapeutycznych przy konwencjonalnym leczeniu metronidazolem i wankomycyną.
Pomimo ograniczonego doświadczenia klinicznego, wstępnie wykazano, że bakterioterapia kałowa zapewnia wysoki odsetek wyleczeń klinicznych, jednak do tej pory brakuje randomizowanych badań klinicznych dotyczących tego podejścia terapeutycznego.
Wrzodziejące zapalenie jelita grubego
We wrzodziejącym zapaleniu jelita grubego nie wykryto dotychczas żadnego patogenu.
Jednak skuteczność bakterioterapii kałowej w tym przypadku sugerowałaby, że przyczyną wrzodziejącego zapalenia jelita grubego może być wcześniejsze zakażenie nieznanym patogenem.
Rzeczywiście, początkowa infekcja mogła prawdopodobnie ustąpić naturalnie u tych pacjentów; ale czasami brak równowagi we florze jelitowej okrężnicy może prowadzić do zaostrzenia stanu zapalnego (co wyjaśniałoby cykliczny i nawracający charakter tej choroby).
Wydaje się, że cykl ten, przynajmniej w wielu przypadkach, zostaje przerwany przez ponowną kolonizację okrężnicy pacjenta kompleksem bakteryjnym (probiotykiem) pobranym ze zdrowego jelita (heteroprzeszczep).
Niektórzy lekarze uważają, że ten zabieg przeprowadzany u osób zdrowych jest bezpieczny i wielu pacjentów mogłoby skorzystać z tej innowacyjnej terapii.
Badanie przeprowadzone w maju 2011 roku potwierdziło dobrą gotowość pacjentów i rodziców dzieci z wrzodziejącym zapaleniem jelita grubego do zaakceptowania tego leczenia po przezwyciężeniu początkowej niechęci do tej metody.
W 2013 roku kolejne badania potwierdziły zasadność terapii prospektywnym badaniem pilotażowym na 7 osobach w wieku 21-XNUMX lat.
To badanie pokazuje tolerancję i skuteczność przeszczepu kału we wrzodziejącym zapaleniu jelita grubego; w rzeczywistości u siedmiu pacjentów nastąpiła remisja kliniczna w ciągu jednego tygodnia, a u sześciu z dziewięciu osób utrzymała się remisja kliniczna po jednym miesiącu.
Transplantacja kału, inne choroby badane pod kątem bakterioterapii kału
Technika ta jest obecnie badana u pacjentów z chorobą Parkinsona, cukrzycą, otyłością, zespołem jelita drażliwego, przewlekłą chorobą zapalną jelit, stwardnieniem rozsianym, idiopatyczną plamicą małopłytkową, chorobą Leśniowskiego-Crohna, insulinoopornością i zespołem przewlekłego zmęczenia.
Klasyczna procedura
Zwykle stosuje się kał bliskiego, zdrowego krewnego pacjenta po zbadaniu i wykluczeniu obecności zakaźnych bakterii lub wirusów lub pasożytów, takich jak: Salmonella, wirus zapalenia wątroby itp.
Po pobraniu próbka kału jest przetwarzana i przygotowywana w laboratorium klinicznym w postaci płynnej zawiesiny, którą następnie wprowadza się do górnego odcinka przewodu pokarmowego przez sondę nosowo-żołądkową sięgającą do poziomu jelita ślepego.
Procedura obejmuje czasami 5-10 dni leczenia lewatywami, wykonanymi z ludzkiej mikrobioty z kału zdrowego dawcy; większość pacjentów wraca do zdrowia już po jednym zabiegu.
Najlepszym wyborem dawcy jest bliski krewny, który został przebadany pod kątem szerokiego zakresu czynników bakteryjnych i pasożytniczych.
Lewatywy są przygotowywane i podawane w środowisku szpitalnym, aby zapewnić niezbędną opiekę.
Wlew probiotyku można również wykonać przez sondę nosowo-żołądkową, dostarczając bakterie bezpośrednio do jelita cienkiego.
Obie metody można łączyć w celu uzyskania najlepszego efektu.
Regularne badania kontrolne należy wykonywać do roku po zabiegu.
ARGF (autologiczne odtworzenie flory przewodu pokarmowego)
Zmodyfikowaną formą bakterioterapii kałowej, nad którą obecnie pracujemy, jest autologiczne odtworzenie flory przewodu pokarmowego – (ARGF).
Ta metoda jest bezpieczniejsza, skuteczniejsza i łatwiejsza w stosowaniu.
Autologiczna (własna) próbka kału jest dostarczana przez pacjenta przed zabiegiem i przechowywana w lodówce.
Jeśli u pacjenta później rozwinie się patologia C. difficile, próbkę ekstrahuje się solą fizjologiczną i filtruje. Przesącz liofilizuje się, a otrzymaną substancję stałą zamyka się w kapsułkach dojelitowych.
Podanie kapsułek przywraca własną florę okrężnicy pacjenta, co jest przydatne w zwalczaniu ewentualnych infekcji C. difficile.
Procedura ta pozwala uniknąć ryzyka klasycznej bakterioterapii kału, w której ewentualna infekcja mogłaby zostać przeniesiona na pacjenta przez dawcę, a także pozwala uniknąć konieczności podawania próbki kału do dwunastnicy przez sondę żołądkową.
Skuteczność
Skuteczność metody w zapobieganiu nawrotom rzekomobłoniastego zapalenia jelita grubego ocenia się na około 90%.
Potwierdza to badanie z grudnia 2011 roku, wykazujące 92% skuteczność metody w zapobieganiu biegunkom lub dalszym nawrotom w grupie 26 pacjentów z nawracającymi zakażeniami C. difficile.
Fińskie badanie z 2011 roku wskazuje, że antybiotykoterapia nawracających zakażeń Clostridium difficile (CDI) prowadzi do nawrotów u 50% pacjentów.
Zastosowanie przeszczepu kału podczas zabiegu kolonoskopii po preparacji jelit glikolem polietylenowym (płukanie) spowodowało ustąpienie 89% przypadków nawrotu rzekomobłoniastego zapalenia jelita grubego w rocznej obserwacji, podkreślając, że leczone przypadki były spowodowane przez szczególnie zjadliwy szczep C. difficile (typ 027).
Również w grudniu 2011 roku przegląd 317 pacjentów wykazał 92% skuteczność metody, wykazując również kilka skutków ubocznych.
W 2015 roku opublikowano badanie porównawcze z wankomycyną wykazujące wyższość bakteryjnej terapii kałowej nad tym antybiotykiem.
Czytaj także
Emergency Live jeszcze bardziej…Live: Pobierz nową darmową aplikację swojej gazety na iOS i Androida
Zapalenie jelita grubego: objawy, leczenie i co jeść
Wrzodziejące zapalenie jelita grubego: przyczyny, objawy i leczenie
Bakterie jelitowe dziecka mogą przewidzieć przyszłą otyłość
Transplantacja mikroflory kałowej (transplantacja kału): do czego służy i jak jest wykonywana?
Sant'Orsola w Bolonii (Włochy) otwiera nową medyczną granicę dzięki transplantacji mikrobioty
Odkryto mikrobiotę, rolę „bramy”, która chroni mózg przed zapaleniem jelit
Jakie są różnice między zapaleniem uchyłków a uchyłkowatością?
Co to jest biopsja igłowa piersi?
Kolonoskopia: najnowsze techniki i różne typy
Dysbioza i terapia hydrokolonialna: jak przywrócić dobre samopoczucie jelit
Endoskopia kapsułkowa: co to jest i jak jest wykonywana
Kolonoskopia: co to jest, kiedy to zrobić, przygotowanie i zagrożenia
Płukanie okrężnicy: co to jest, do czego służy i kiedy należy to zrobić
Rektosigmoidoskopia i kolonoskopia: czym są i kiedy są wykonywane
Wrzodziejące zapalenie jelita grubego: jakie są typowe objawy choroby jelit?
W Walii śmiertelność z powodu operacji jelita jest „wyższa niż oczekiwano”
Zespół jelita drażliwego (IBS): łagodny stan, który należy utrzymać pod kontrolą
Infekcje jelitowe: w jaki sposób dochodzi do zakażenia Dientamoeba Fragilis?
Badanie wykazało związek między rakiem okrężnicy a stosowaniem antybiotyków
Kolonoskopia: bardziej efektywna i zrównoważona dzięki sztucznej inteligencji
Resekcja jelita grubego: w jakich przypadkach konieczne jest usunięcie okrężnicy?
Gastroskopia: po co jest badanie i jak się je wykonuje
Refluks żołądkowo-przełykowy: objawy, diagnoza i leczenie
Endoskopowa polipektomia: co to jest, kiedy jest wykonywana
Unoszenie prostej nogi: nowy manewr w diagnostyce choroby refluksowej przełyku
Gastroenterologia: endoskopowe leczenie refluksu żołądkowo-przełykowego
Zapalenie przełyku: objawy, diagnoza i leczenie
Refluks żołądkowo-przełykowy: przyczyny i środki zaradcze
Gastroskopia: co to jest i do czego służy
Choroba uchyłkowa okrężnicy: diagnostyka i leczenie uchyłkowatości okrężnicy
Choroba refluksowa przełyku (GERD): objawy, diagnoza i leczenie
Uchyłki: jakie są objawy zapalenia uchyłków i jak je leczyć
Zespół jelita drażliwego (IBS): łagodny stan, który należy utrzymać pod kontrolą
Refluks żołądkowo-przełykowy: przyczyny, objawy, testy diagnostyczne i leczenie
Chłoniak nieziarniczy: objawy, diagnostyka i leczenie niejednorodnej grupy nowotworów
Helicobacter Pylori: jak go rozpoznać i leczyć



