آکروژیگانتیسم مرتبط با X: مطالعه جدیدی برای شناسایی مکانیسم های مولکولی
Acrogigantism: پروژه تحقیقاتی دکتر Giampaolo Trivellin، محقق در Humanitas، در مارس 2020 آغاز شد و به لطف برنده شدن ماری اسکلودوسکا کوری Action-Individual Fellowship 2018 و کمک هزینه بنیاد Telethon (شروع شده در ژوئن 2021)، به یک امتیاز رسیده است. اولین نتیجه گیری مهم
همانطور که در مطالعه "تکثیرها معماری کروماتین را مختل می کند و ارتباط تقویت کننده GPR101 را در آکروژیگانتیسم وابسته به X برقرار می کند" منتشر شده در 23 فوریه 2022 در مجله علمی American Journal of Human Genetics، دکتر تریولین توانست بینشی در مورد مکانیسم های پاتولوژیک به دست آورد. آکروژانتیسم مرتبط با X (X-LAG).
X-LAG یک بیماری ژنتیکی نادر است که در حال حاضر در حدود 40 نفر در سراسر جهان، یعنی 10 درصد از بیماران مبتلا به غول پیکری هیپوفیز، یک آسیب شناسی مرتبط با اختلال عملکرد غده هیپوفیز، تشخیص داده می شود.
آکروژیگانتیسم: چیست
آکروژیگانتیسم مرتبط با X برای اولین بار توسط تیم دکتر تریولین در سال 2014 توصیف شد و وضعیتی است که ناشی از نقص ژنتیکی واقع در کروموزوم X است: به طور خاص، تکرار ژن حاوی دستورالعمل های تولید گیرنده غشایی به نام GPR101.
تکرار GPR101 با تومور غده هیپوفیز همراه است که باعث ترشح بیش از حد هورمون رشد (GH) می شود.
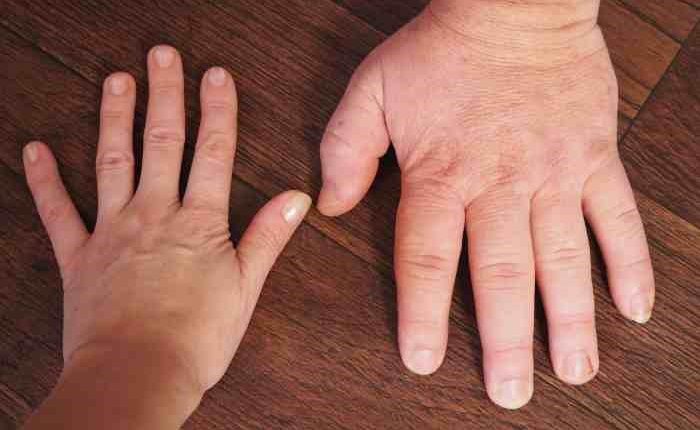
در میان علائم بالینی مختلف آکروژیگانتیسم، بارزترین آن رشد بیش از حد بدن بیماران است که در صورت عدم درمان معمولاً قد آنها از 2 متر فراتر می رود.
اگرچه هیچ درمانی برای X-LAG وجود ندارد، اما در حال حاضر می توان آن را با رویکردی چند رشته ای شامل جراحی، درمان پزشکی و به ندرت رادیوتراپی درمان کرد.
مطالعه پژوهشی آکروژیگانتیسم
دکتر تریولین و تیم تحقیقاتی او نقش ژن GPR101 و مکانیسمهای مولکولی را که باعث بیان مشخص آن در تومورهای هیپوفیز میشوند، مکانیسمهایی که تاکنون ناشناخته بودند، بررسی کردند.
این مطالعه نشان داد که علت بیان بیش از حد آن در تغییر دامنه کروماتینی است که ژن در آن قرار دارد.
این تغییر در اثر تکراری شدن بیماری ایجاد می شود.
DNA ما به حوزههای کروماتین یا TAD (دامنههای مرتبط توپولوژیکی) تقسیم میشود، که عملکرد آنها برای جدا نگه داشتن ژنهای واقع در آنها از بقیه ژنوم است.
این تقسیمبندی تضمین میکند که عملکرد عناصر تنظیمکننده (افزایشدهنده)، که بیان ژن را تقویت میکنند، تنها به ژنهای واقع در همان حوزه کروماتین محدود میشود.
برخلاف سایر ژنهایی که معمولاً با GPR101 در بیماران X-LAG تکرار میشوند، GPR101 تنها ژنی است که در حوزه کروماتین خودش جدا شده است.
در بیماران، بازآرایی دامنههای کروماتین ناشی از تکثیر ژن وجود دارد و در نتیجه یک دامنه کروماتین جدید ایجاد میشود که در آن ژن GPR101 دیگر از توالیهای تقویتکننده سایر ژنها جدا نمیشود، اما اکنون با آنها تعامل دارد.
این فعل و انفعالات پاتولوژیک جدید است که منجر به بیان مشخص GPR101 در تومورهای بیماران می شود.
آکروژیگانتیسم، چشم اندازهای آینده
کشف این مکانیسم که برای اولین بار در غدد درون ریز توسط مطالعه دکتر تریولین توصیف شد، چشم انداز تحقیقات بیشتری را هم برای بیماری های غده هیپوفیز و هم برای سایر اختلالات غدد درون ریز که می توانند از طریق مکانیسم های پاتولوژیک مشابه ایجاد شوند، باز می کند.
دانستن اینکه چه چیزی بیان بیش از حد گیرنده GPR101 را تعیین میکند، محرک آبشار سیگنالهای درون سلولی که منجر به تولید بیش از حد هورمون رشد میشود، در یک دیدگاه درمانی جدید برای بیماران مبتلا به غولپیکری اساسی خواهد بود.
این اولین گام به سوی توسعه آینده درمانهایی است که به طور خاص توالیهای تقویتکنندهای را که با GPR101 در بیماران مبتلا به آکروژیگانتیسم تعامل دارند، مهار میکنند: خاموش کردن بیان بیش از حد ژن GPR101 باعث کاهش ترشح بیش از حد هورمون رشد و علائم ناتوانکننده مرتبط با آن میشود.
همچنین بخوانید:
COVID-19 در افراد مبتلا به سندرم داون: مرگ و میر تا 10 برابر بیشتر. مطالعه ISS
سندرم داون و COVID-19 ، تحقیق در دانشگاه ییل
کودکان مبتلا به سندروم داون: علائم اولیه رشد آلزایمر در خون



